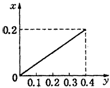
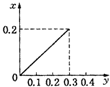
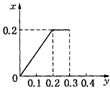
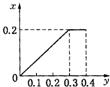
将22.4g铁粉逐渐加入到含HNO3 0.8mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是( )
A.
B.
C.
D.
22.4g铁的物质的量为
=0.4mol,令铁完全反应需硝酸的物质的量为n,则:22.4g 56g/mol
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+H20
1 4
0.4mol n
所以n=1.6mol,由于1.6mol>0.8mol,所以Fe有剩余,根据硝酸计算生成NO的物质的量,参加反应生成NO的Fe的物质的量,则:
Fe+4HNO3(稀)=Fe(NO3)3 +NO↑+H20
1mol 4 mol 0.1mol
0.2mol 0.8mol 0.2mol
根据生成NO的物质的量,参加反应生成NO的Fe的物质的量作图,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系如图:
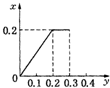
故选:C.
