问题
问答题
3.84gFe和Fe2O3的混合物溶于过量盐酸中,生成0.03molH2,向反应后的溶液中加入KSCN检验,溶液无明显现象.求原混合物中Fe2O3的质量.
答案
设Fe为xmol,Fe2O3为ymol,
反应的方程式分别为Fe2O3+6HCl═2FeCl3+H2O,2FeCl3+Fe═3FeCl2,Fe+2HCl═FeCl2+H2↑,
由于反应后的溶液中加入KSCN检验,溶液无明显现象,则说明FeCl3完全反应,溶液中只生成FeCl2,
则有:
Fe2O3+6HCl═2FeCl3+H2O,
ymol 2ymol
2FeCl3+Fe═3FeCl2,
2ymol ymol
Fe+2HCl═FeCl2+H2↑,
(x-y)mol 0.03mol
则有:56X+160y=3.84 x=y+0.03
解之得:x=0.04,y=0.01,
所以Fe2O3的质量为0.01mol×160g/mol=1.6g.
答:原混合物中Fe2O3的质量为1.6g.

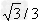 ,g取10m/s2,则在这个过程中
,g取10m/s2,则在这个过程中