某部分变质的NaOH试剂经处理后只含有NaOH和Na2CO3两种物质。小明同学从中均匀取出9.3g样品用19.9g水溶解后,再向其中缓慢滴加10%的稀盐酸至恰好完全反应时,用去稀盐酸73g,经测定共放出气体2.2g。
(1)向样品中加入稀盐酸至恰好完全反应时,发生的两个反应可用化学方程式表示为:
_______________________________________,_______________________________________;
9.3g样品中,含Na2CO3的质量为_____________g,含NaOH的质量为_____________g。
(2)通过计算确定原NaOH试剂的变质程度。(用质量百分数表示)
(3)上述恰好完全反应后的溶液中,溶质的质量分数是多少?(用百分数表示,保留一位小数)
(1)NaOH+HCl=NaCl+H2O(1分);(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑(1分)
5.3(1分) 4(1分)
(2)设变质生成5.3g碳酸钠的氢氧化钠质量为x
2NaOH+CO2=Na2CO3+H2O
80 106
x 5.3g
x=4g(1分)
则原氢氧化钠试剂的变质程度为=……=50%(1分)
(3)设9.3g样品与稀盐酸反应后共生成氯化钠的质量为y
由(1)中反应方程式可知生成的氯化钠与所用盐酸的关系为
HCl——NaCl
36.5 58.5
73g×10% y
y=11.7g
或:根据质量守恒定律,反应前后的钠元素质量不变,则有下列关系
NaOH——NaCl
40 58.5
8g y
y=11.7g
反应后溶液的质量为9.3g+19.9g+73g-2.2g=100g
(11.7g、100g算对一个或两个均给1分)
反应后的溶液的溶质质量分数=……=11.7%(1分)
答:反应后溶液中溶质的质量分数11.7%。
分析:(1)根据氢氧化钠、碳酸钠与盐酸反应规律,写出两个反应的化学方程式;并根据反应的化学方程式,由生成二氧化碳的质量计算样品中碳酸钠的质量及氢氧化钠质量;
(2)原NaOH试剂的变质程度可用变质的氢氧化钠的质量占变质前氢氧化钠的总质量的质量分数表示,因此需要根据变质反应的化学方程式计算出变了质的氢氧化钠的质量;
(3)恰好完全反应后的溶液为氯化钠溶液,其中溶质的质量分数= ×100%,氢氧化钠、碳酸钠与盐酸反应都生成氢氧化钠,因此可根据消耗盐酸的质量计算反应生成的氯化钠的质量;反应后溶液的质量可利用质量守恒定律进行求得.
×100%,氢氧化钠、碳酸钠与盐酸反应都生成氢氧化钠,因此可根据消耗盐酸的质量计算反应生成的氯化钠的质量;反应后溶液的质量可利用质量守恒定律进行求得.
解:(1)氢氧化钠与盐酸发生中和反应生成氯化钠和水,反应的化学方程式为NaOH+HCl═NaCl+H2O;碳酸钠则与盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl═2NaCl+CO2↑+H2O;
设样品中碳酸钠的质量为m
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 44
m 2.2g
 =
=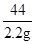
m=5.3g
则样品中氢氧化钠的质量=9.3g-5.3g=4g
故答案为:NaOH+HCl═NaCl+H2O、Na2CO3+2HCl═2NaCl+CO2↑+H2O;5.3g;4g.
(2)设变质生成5.3gNa2CO3的NaOH质量为x.
2NaOH+CO2═Na2CO3+H2O
80 106
x 5.3g
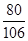 =
=
x=4g
则原NaOH试剂的变质程度为: ×100%=50%
×100%=50%
答:原NaOH试剂的变质程度为50%;
(3)设9.3g样品与稀盐酸反应后共生成的NaCl的质量为y,由(1)中反应方程式可知生成的NaCl与所用的HCl的关系为
NaCl~HCl
58.5 36.5
y 73 g×10%
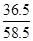 =
=
y="11.7" g
反应后溶液的质量为:9.3 g+19.9 g+73 g-2.2 g="100" g
反应后的溶液中溶质的质量分数为:
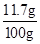 ×100%×100%=11.7%
×100%×100%=11.7%
答:反应后溶液中溶质的质量分数为11.7%.
点评:根据质量守恒定律,反应后所得溶液质量=固体混合物的质量+溶解所加水的质量+所加稀盐酸的质量-放出的气体二氧化碳的质量
