问题
计算题
(11分)现将N2和H2在一定条件下合成氨。
(1)有一体积比为2∶3的N2和H2的混合气体,在一体积不变的密闭容器中发生反应,达到平衡时,容器内的压强为反应开始时的4/5,求:
①N2的转化率?
②平衡时n(N2)、n(H2)和n(NH3)的体积比是多少?
(2)在一定条件下,将一定量的N2和H2混合气体合成氨,达平衡时,混合气体中NH3的体积分数为25%。若反应前后条件相同,则反应从开始到平衡缩小的气体体积与原反应物气体体积的比值是多少?
答案
(1)①N2的转化率为25%
②n(N2)∶n(H2)∶n(NH3)="3∶3∶2 " (2)1∶5
(1)①设反应达平衡时N2转化了x体积。
N2+3H2 2NH3
2NH3
起始量 2 3 0
变化量 x 3 x 2x
平衡量 2-x 3-3x 2x
则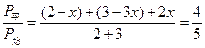 ,解得 x=0.5。
,解得 x=0.5。
则N2转化率为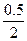 ×100%=25%。
×100%=25%。
②n(N2)∶n(H2)∶n(NH3)=3∶3∶2
(2)设原混合气体中N2为a mol、H2为b mol,平衡时NH3为x mol。
N2+3H2 2NH2
2NH2
起始量 a b 0
变化量 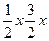 x[即反应前后,体系缩小体积为(
x[即反应前后,体系缩小体积为(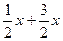 )-x=x]
)-x=x]
平衡量 a-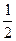 x
x 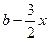 x
x
依题意有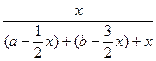 ×100%=25%,
×100%=25%,
解之得: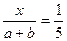 ,即反应后缩小的气体体积与原反应物气体体积之比为1∶5。
,即反应后缩小的气体体积与原反应物气体体积之比为1∶5。
