(8分)一定温度下,向装有固体催化剂且容积不变的密闭容器中通入1 mol N2和4 mol H2,使之发生如下反应:
N2(g)+3H2(g)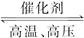 2NH3(g);ΔH=-92.4 kJ·mol-1。
2NH3(g);ΔH=-92.4 kJ·mol-1。
平衡时容器内气体压强为起始时的80%。
(1)通入1 mol N2和4 mol H2,达到平衡时,放出的热量为__________。
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为a mol N2、b mol H2、c mol NH3。
①达到相同的平衡时,(1)与(2)放出的热量值__________ (填序号)。
A.一定相等
B.前者一定小
C.前者大于或等于后者
D.不能确定②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示)___________,___________。
③欲使起始时反应表现为向正反应方向进行,a的取值范围是__________。
(1)46.2 kJ (2)①C
②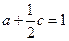 ,
,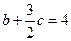 或2a+c=2,2b+3c="8 " ③0.5<a≤1
或2a+c=2,2b+3c="8 " ③0.5<a≤1
本题考查平衡的有关计算,考查学生的计算能力和思维能力。
思路如下:(1)
N2 + 3H2 2NH3 Δn=2
2NH3 Δn=2
起始 1 mol 4 mol 0
平衡0.5 mol 1.5 mol 1 mol 5 mol-4 mol="1" mol
所以放出热量=0.5 mol×92.4 kJ· mol-1=46.2 kJ
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为a mol N2、b mol H2、c mol NH3,前者和后者是等效平衡。前者向正方向进行,后者不一定,所以选C。运用“一边倒”规律,NH3转化后为c/2 mol N2、3c/2 mol H2,所以a+c="1" mol,b+c="4" mol,转化后为2a+c=2,2b+3c=8。由(1)可知平衡时N2为0.5 mol,起始时反应表现为向正反应方向进行,所以0.5<a≤1。
