(10分) A、B、C、D是由前18号元素组成的四种常见化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如下反应关系:
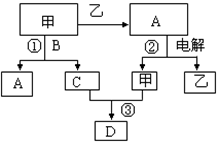
(1)上述转化过程中包含的反应类型为 。
a置换反应 b化合反应 c分解反应 d复分解反应
(2)乙在甲中燃烧,当有1 mol e-转移,生成液态A时,放出142.9 kJ的热量,写出该反应的热化学方程式: 。
(3)反应③在一定条件下为可逆反应,经过一段时间该反应达到平衡,写出该反应的化学方程式: 。若将3 mol甲和4 mol C混合充入容积为2 L的密闭容器中,2分钟后,达到平衡。平衡后混合气总物质的量为6 mol,甲的化学反应速率为 。将该平衡混和物缓慢通入水中得到1L溶液,所得溶液物质的量浓度是____________。
(1)b、c
(2)H2(g ) + 1/2 O2(g) = H2O(l) ;△H="-285.8" kJ/mol
(3)2 NO + O2 2NO2 ;0.25 mol/(L·min);4mol/L
2NO2 ;0.25 mol/(L·min);4mol/L
D为红棕色气体,即NO2;
由“乙在甲中燃烧生成液态A”可推得甲为氧气,A为水,乙为氢气;
C与甲(氧气)可生成NO2,可猜测C为氮气或NO;而甲(氧气)与B可生成C与A(水),可知B为氨气:4NH3+5O2 4NO+6H2O,可判定B为氨气,C为NO
4NO+6H2O,可判定B为氨气,C为NO
(1)涉及反应为:2H2+O2 2H2O(化合反应)、2H2O
2H2O(化合反应)、2H2O 2H2↑+O2↑(分解反应)、4NH3+5O2
2H2↑+O2↑(分解反应)、4NH3+5O2 4NO+6H2O、2 NO + O2
4NO+6H2O、2 NO + O2 2NO2(化合反应);反应类型为化合反应和分解反应;
2NO2(化合反应);反应类型为化合反应和分解反应;
(2)反应2H2+O2 2H2O中转移电子数为4个,故1molH2完全燃烧放出的热量为285.8 kJ,对应的热化学方程式为:H2(g ) + 1/2 O2(g) = H2O(l) ;△H="-285.8" kJ/mol
2H2O中转移电子数为4个,故1molH2完全燃烧放出的热量为285.8 kJ,对应的热化学方程式为:H2(g ) + 1/2 O2(g) = H2O(l) ;△H="-285.8" kJ/mol
(3)反应:2 NO + O2 2NO2
2NO2
初n: 4 3 0
△n: 2x x 2x
平衡n: 4—2x 3—x 2x
4—2x+3—x+2x=6,x=1
v(甲)= 0.25 mol/(L·min)
0.25 mol/(L·min)
由反应NO+NO2+O2+H2O=2HNO3可知生成硝酸为4mol,浓度为4mol/L
