(12分)以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
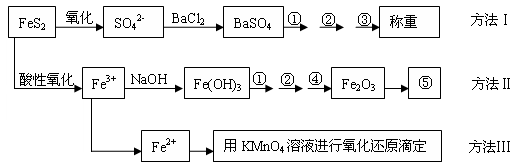
请回答下列问题:
(1)判断溶液中SO42-离子已沉淀完全的方法是 。
(2)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是 。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,准确称取1.60 g,的矿石试样,试样经溶解、预处理后,(A)配制成100.00mL试样溶液;(B)用滴定管量取25.00 mL待测溶液,用酸性0.1mol/LKMnO4标准溶液滴定待测试样;(C)读取并计算滴定管中消耗的KMnO4标准溶液体积,计算试样中的Fe元素含量。
发生反应的离子方程式为 。
(4)若矿石中含有FeS与FeS2,实验称取矿石试样1.60 g, 按方法Ⅰ分析,称得BaSO4的质量为4.66 g,按方法Ⅲ分析消耗的KMnO4标准溶液体积7.50mL,假设石中的硫元素全部来自于FeS和FeS2,则该矿石中FeS2和FeS比值为 。(写出计算过程)
(1)取上层清液滴加BaCl2溶液,若无白色沉淀生成,说明SO42-沉淀完全
(2)有三个可能的原因:(写出其中一种,即给2分)
① Fe(OH)3沉淀表面积大,易吸附杂质
② 过滤洗涤时未充分将吸附的杂质洗去
③ Fe(OH)3灼烧不充分,未完全转化为Fe2O3
(3)MnO4-+ 5Fe2++8H+= Mn2++5Fe3++4H2O
(4)1.60 g矿石中含有n(S)= n(SO42-)= n(BaSO4)=4.66÷233=0.02mol
含有n(Fe2+)= 5n(MnO4-)×4=5×0.1×0.0075×4=0.015mol
则有:n(FeS)+n(FeS2)= 0.015
n(FeS)+2n(FeS2)= 0.02
解之得n(FeS)=0.01mol n(FeS2)=0.005mol
n(FeS):n(FeS2)= 0.01:0.005=2:1
题目分析:(1)取上层清液滴加BaCl2溶液,若无白色沉淀生成,说明SO42-沉淀完全;(2)称量的固体质量高,导致结果偏高,故可能的原因有:① Fe(OH)3沉淀表面积大,易吸附杂质 ② 过滤洗涤时未充分将吸附的杂质洗去 ③ Fe(OH)3灼烧不充分,未完全转化为Fe2O3;
(4)1.60 g矿石中含有n(S)= n(SO42-)= n(BaSO4)=4.66÷233=0.02mol
含有n(Fe2+)= 5n(MnO4-)×4=5×0.1×0.0075×4=0.015mol
则有:n(FeS)+n(FeS2)= 0.015
n(FeS)+2n(FeS2)= 0.02
解之得n(FeS)=0.01mol n(FeS2)=0.005mol
n(FeS):n(FeS2)= 0.01:0.005=2:1
