(10分)天然气的主要成分是甲烷。在某平衡体系中存在CH4、H2O、CO、H2四种气体,
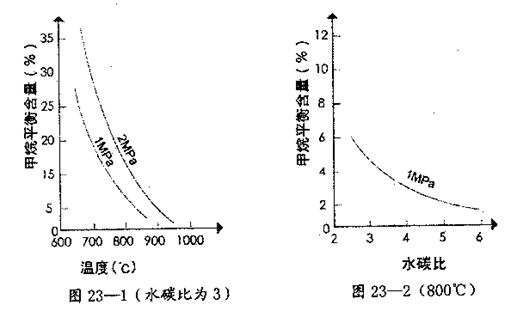
其平衡常数表达式为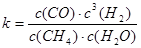 。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:
。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:
请回答下列问题:
(1)写出该可逆反应的化学方程式:
(2)根据图23—1判断△H 0,△S 0(选填“>”、“<”或“=”)。
(3)假设上述反应在恒容、恒温下进行,判断反应达到平衡状态时的标志是
A.CO减少的化学反应速率和H2O(曲减少的化学反应速率相等
B.CO、H2O(g)、CH4、H2的浓度都相等
C.CO、H20(g)、CH4、H2的浓度都不再发生变化
D.正、逆反应速率都为零(4)在图23—2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
(10分)
 (1)CH4(g)+H2O(g) CO(g)+3H2(g)(2分)
(1)CH4(g)+H2O(g) CO(g)+3H2(g)(2分)
(2)>(2分) >(2分)
(3)AC(2分)
(4)(2分,说明只要2Mpa线在1Mpa线上方均给分)
分析:(1)根据平衡常数可知,反应中CO和H为生成物,CH4和H2O为反应,以此书写反应的化学方程式;
(2)根据平衡移动曲线的变化特点判断反应热,根据混乱度的变化来判断熵变;
(3)根据化学平衡为动态平衡,达到平衡时正逆反应速率相等,各物质的浓度不再发生改变来判断平衡状态;
(4)根据压强增大平衡向逆反应方向移动来画出曲线.
解答:解:(1)根据平衡常数可知,反应中CO和H为生成物,CH4和H2O为反应,
反应的化学方程式为CH4(g)+H2O(g)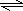 CO(g)+3H2(g),
CO(g)+3H2(g),
故答案为:CH4(g)+H2O(g)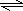 CO(g)+3H2(g);
CO(g)+3H2(g);
(2)根据图象中曲线的变化趋势可知,当温度升高时,甲烷的百分含量减小,说明升高温度平衡向逆反应方向移动,则正反应吸热,△H>0,生成物气体的物质的量大于反应物气体的物质的量,混乱度增大,则△S>0,
故答案为:>;>;
(3)A.CO减少的化学反应速率和H2O减少的化学反应速率相等,说明正逆反应速率相等,达到平衡状态,故A正确;
B.CO、H2O(g)、CH4、H2的浓度都相等,不能说明达到平衡状态,平衡时各物质的浓度取决于反应时各种物质的配比数和反应的程度,故B错误;
C.CO、H20(g)、CH4、H2的浓度都不再发生变化,说明达到平衡状态,故C正确;
D.正、逆反应速率都为零,不正确,化学平衡为动态平衡,平衡时正逆反应速率相等,不为0,故D错误.
故答案为:AC;
(4)压强增大,平衡向逆反应方向移动,甲烷的平衡含量减小,故答案为: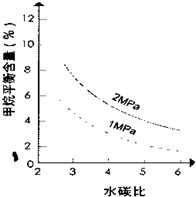
点评:本题考查化学平衡移动以及平衡移动图象问题,题目难度不大,本题注意把握如何判断平衡状态的标志问题.
