在下面反应中,2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)氧化剂是______,氧化产物是______.
(2)用“双线桥”标出电子转移的方向和数目.
(3)该反应中被氧化和未被氧化的盐酸的物质的量之比是______,若有7.3g HCl被氧化,产生Cl2的质量为______g,转移电子______mol.
(4)如果将20ml12mol•L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将______.
A.≥1.68LB.>1.68LC.≤1.68LD.<1.68L.
在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素的化合价降低,Cl元素的化合价升高,
(1)Mn元素的化合价降低,则KMnO4为氧化剂,Cl元素的化合价升高,所以氧化产物为,故答案为:KMnO4;Cl2;
(2)该反应中Mn得到2×5e-,Cl失去10×e-,则双线桥法表示反应转移的电子的方向和数目为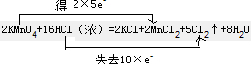 ,
,
故答案为: ;
;
(3)由反应可知,16molHCl反应时只有10molHCl作还原剂别氧化,所以该反应中被氧化和未被氧化的盐酸的物质的量之比是10:6=5:3;
若有7.3g HCl被氧化,n(HCl)=
=0.2mol,则产生Cl2的质量为0.1mol×71g/mol=7.1g,转移电子为0.1mol×2×1=0.2mol,7.3g 36.5g/mol
故答案为:5:3;7.1;0.2;
(4)20ml12mol•L-1的浓盐酸与足量KMnO4充分反应,n(HCl)=0.02L×12mol/L=0.24mol,若完全反应生成氯气为0.24mol×
=0.075mol,其体积为0.075mol×22.4L/mol=1.68L,但随反应进行,浓盐酸变为稀盐酸,不再发生氧化还原反应,则产生氯气小于1.68L,5 16
故答案为:D.
