问题
选择题
已知一定温度下,2X(g)+Y(g) 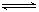 mZ(g) ΔH=-a kJ·mol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ;向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是( )
mZ(g) ΔH=-a kJ·mol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ;向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是( )
A.m=4
B.a=b
C.a<
D.m≤2
答案
答案:D
b>2c,说明甲容器中X的转化率对于乙容器中X的转化率。因为甲容器中X和Y的物质的量均是Y容器的2倍,这说明增大压强平衡是向正反应方向移动的,即m<3。因为是可逆反应,所以入2 mol X和1 mol Y反应,达到平衡状态时,放出热量不可能是a kJ,即a>b。答案是D。
