(19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
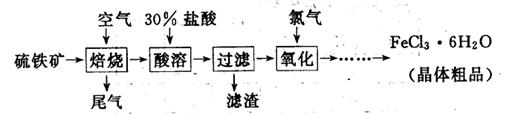
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
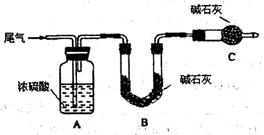
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
(19分)
(1)2Fe2+ + Cl2= 2Cl- + 2Fe3+(2分) KSCN溶液(1分,其它合理答案也给分)
(2)方案一:①干燥管(1分) 防止空气中的水蒸气、CO2被B装置吸收(2分)
②否(1分) 尾气中的CO2也能被B装置吸收使所测质量分数偏大(2分)
方案二:①使生成的SO42-完全转化为沉淀(2分)
②在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作(2分)
③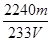 %(2分)
%(2分)
(3)蒸发浓缩(2分)
Fe3+ + 3H2O  Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解(2分)
Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解(2分)
题目分析:(1)滤液中含有Fe2+,通入Cl2发生氧化还原反应,离子方程式为:2Fe2+ + Cl2= 2Cl- + 2Fe3+;检验Fe3+的试剂为KSCN溶液,若溶液变红,说明含有Fe3+。
(2)方案一:①根据实验装置图可知,C仪器的名称是干燥管;外界空气中含有CO2、水分,可能被B中碱石灰吸收,所以C装置的作用是:防止空气中的水蒸气、CO2被B装置吸收。
②因为尾气中含有CO2,也能办碱石灰吸收,使所测质量分数偏大,所以方案一不合理。
方案二:①溴水与SO2反应生成H2SO4,加入过量的BaCl2溶液,Ba2+与SO42‾反应,使生成的SO42-完全转化为沉淀。
②洗涤沉淀的方法是:在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作。
③根据化学方程式和S元素守恒可得对应关系:SO2~ BaSO4,所以SO2含量的表达式是:mg÷233g/mol×22.4L/mol÷VL×100% =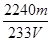 %
%
(3)从FeCl3溶液中得到FeCl3 6H2O晶体,应蒸发浓缩,再冷却结晶、过滤,因为FeCl3为强酸弱碱盐,能发生水解反应:Fe3+ + 3H2O
6H2O晶体,应蒸发浓缩,再冷却结晶、过滤,因为FeCl3为强酸弱碱盐,能发生水解反应:Fe3+ + 3H2O  Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解。
Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解。
