(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”。
①M的原子结构示意图为______。
②以M、Al为电极,KOH溶液为电解质溶液,则负极的电极反应式为______。
(2)淬火是将金属工件加热到某温度,随即浸入淬冷介质中快速冷却的金属热处理工艺。
①使用水进行淬火,若生成磁性氧化铁,该反应的化学方程式为____________
②验证铁用水淬火后的固体产物是否存在+3价的铁,可选用的试剂为_______ (填序号)
A.H2O2溶液
B.铜粉
C.稀硫酸
D.KMnO4溶液(3)髙铁酸钾在水中的反应为4FeO42—+10H2O 4Fe(OH)3+8OH—+3O2
4Fe(OH)3+8OH—+3O2
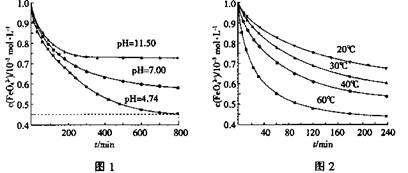
①图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况。pH =4.74时,反应从开始到800min的平均反应速率v(FeO42—)=______ (保留两位有效数字)。
②图1在800min后,三种溶液中K2FeO4的浓度均不再改变。观察图1判断随着pH 变大,此反应的平衡常数______(填“变大”、“变小”或“不变”)。
③图2在240min后,四种溶液中K2FeO4的浓度均不再改变,则上述反应的反应热△H______0(填“>”、“<”、“=”)。
(15分)(1)①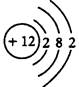 (2分)
(2分)
②Al+4OH——3e—=[Al(OH)4]—或AlO2—+2H2O(2分)
(2)①3Fe+4H2O Fe3O4+4H2↑(3分)
Fe3O4+4H2↑(3分)
②BC(2分)
(3)①6.9×10—7mol•L—1•mol—1(2分)
②不变(2分)
③>(2分)
题目分析:(1)①根据题意可知M为镁,核电荷数为+12,核外电子层结构为282;②镁不溶于KOH溶液,铝能溶于KOH溶液,则铝作负极,发生氧化反应,反应式为Al+4OH——3e—=[Al(OH)4]—或AlO2—+2H2O;(2)①红热的铁与冷水反应,生成四氧化三铁和氢气,即3Fe+4H2O Fe3O4+4H2↑;②Fe3O4是碱性氧化物,能溶于稀硫酸,生成水、Fe3+和Fe2+,双氧水和高锰酸钾均能氧化Fe2+,铜粉能还原Fe3+,Fe3+能氧化铜,故BC正确;(3)①读图可知,△c(FeO42—)=(1.0—0.45)×10—3mol/L,由△c/△t可知,v(FeO42—)=(1.0—0.45)×10—3mol/L÷800min=6.867×10—7mol/(L•min)≈6.9×10—7mol/(L•min);②随着pH变大,但温度不变,故平衡常数不变;③随着温度升高,c(FeO42—)减小,则平衡右移,说明正反应是吸热反应,其△H>0。
Fe3O4+4H2↑;②Fe3O4是碱性氧化物,能溶于稀硫酸,生成水、Fe3+和Fe2+,双氧水和高锰酸钾均能氧化Fe2+,铜粉能还原Fe3+,Fe3+能氧化铜,故BC正确;(3)①读图可知,△c(FeO42—)=(1.0—0.45)×10—3mol/L,由△c/△t可知,v(FeO42—)=(1.0—0.45)×10—3mol/L÷800min=6.867×10—7mol/(L•min)≈6.9×10—7mol/(L•min);②随着pH变大,但温度不变,故平衡常数不变;③随着温度升高,c(FeO42—)减小,则平衡右移,说明正反应是吸热反应,其△H>0。
