学习了MnO2对过氧化氢有催化作用的知识后.某同学想:能否起到类似MnO2的催化剂作用呢?于是进行了如下探究.
【猜想】Ⅰ.Fe2O3不是催化剂、也不参与反应,反应前后质量和化
学性质不变;
Ⅱ.Fe2O3参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.Fe2O3是反应的催化剂,反应前后______.
【实验】用天平称量m1g Fe2O3,取5mL5%的过氧化氢溶液于试管中,进行图15所示实验:
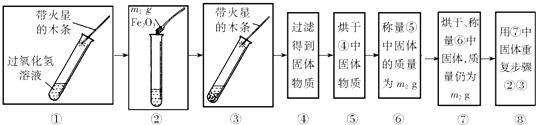
(1)回答下表中问题:
| 步骤③的现象 | 步骤⑥、⑦的结果 | 步骤⑧的现象 | 结论 |
| A.______;______ B.带火星的木条复燃. | m2______m1 (填“大于”、小于“或”等于“”) | A.溶液中有气泡放出; B.______. | 猜想ⅠⅡ不成立; 猜想Ⅲ成立. |
(3)步骤⑧的目的是______.
(4)过氧化氢能被Fe2O3催化分解放出氧气的化学方程式为______.
Ⅲ、催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变;
(1)氧化铁对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铁的质量仍为m1g,即步骤⑥、⑦的结果中的m1g=m2g;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以步骤⑧的现象是溶液中有气泡放出,带火星的木条复燃.
(2)为了看氧化铁是否能改变反应的速率,要通过加入氧化铁与不加氧化铁的现象进行对比,才能得出科学合理的结论,所以步骤①的目的是证明Fe2O3能加快过氧化氢溶液分解的速率.
(3)步骤⑧的目的是证明氧化铜的化学性质在反应前后没有发生改变.
(4)反应物是过氧化氢,催化剂是Fe2O3,生成物是水和氧气,化学方程式是:2H2O2
2H2O+O2↑,其中催化剂是Fe2O3. 催化剂 .
故答案为:(1)
| 步骤③的现象 | 步骤⑥、⑦的结果 | 步骤⑧的现象 | 结论 |
| A. 有气泡; B.带火星的木条复燃. | m2 等于m1 (填“大于”、小于“或”等于“”) | A.溶液中有气泡放出; B. 带火星的木条复燃. | 猜想ⅠⅡ不成立; 猜想Ⅲ成立. |
(3)氧化铜的化学性质在反应前后没有发生改变.
(4)2H2O2
2H2O+O2↑. 催化剂 .
