(18分)工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下:
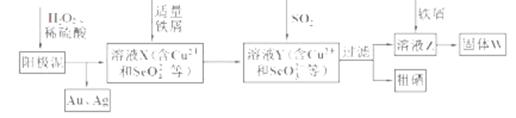
(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
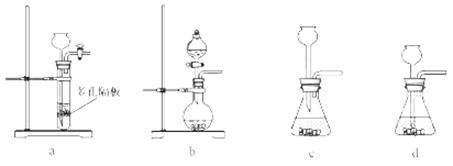
(4)实验室中制取SO2的原理为: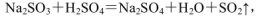 ,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
(5)粗硒中硒的含量可用如下方法测定: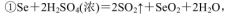
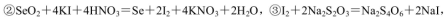 通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol
通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol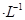 的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
(18分)
(1)将SeO42-还原为SeO32-(2分) 过量铁粉会将Cu2+、SeO32-均还原为单质,不利于硒的分离(2分)
(2)取溶液Z少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-(2分)
(3)粗盐提纯、一定物质的量浓度溶液的配制、物质的溶解、溶液的蒸发、浓硫酸的稀释等(2分,只要正确合理即给分)
(4)较浓的硫酸(2分) SO2易溶于水,用较浓的硫酸有利于 SO2的逸出(2分)
b(2分)
(5)锥形瓶、碱式滴定管(2分) 90.85%(2分)
题目分析:(1)H2O2为强氧化剂,可将阳极泥中的Se单质氧化为SeO42-,根据流程图,加入适量铁屑后生成SeO32-,所以铁屑的作用是:将SeO42-还原为SeO32-;如果铁过量,会继续和Cu2+、SeO32-反应,均被还原为单质,不利于硒的分离。
(2)溶液Z含有的阴离子为SO42‾,检验方法为:取溶液Z少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-。
(3)粗盐提纯、溶液的蒸发,用玻璃棒搅拌,使溶液均匀受热;一定物质的量浓度溶液的配制,用玻璃棒搅拌、引流;物质的溶解、浓硫酸的稀释等。
(4)因为SO2易溶于水,用较浓的硫酸有利于 SO2的逸出,所以制取SO2用较浓的硫酸;a、多孔隔板适用于块状或颗粒比较大的固体与液体反应,Na2SO3为粉末状,不适合;b、分液漏斗适合粉末状固体与液体反应分液漏斗可控制液体的加入量;c、长颈漏斗的导管口在液面以上,气体从长颈漏斗逸出,不适合;d、长颈漏斗不能控制液体的加入量,所以最合适的为b项。
(5)Na2S2O3标准溶液为碱性,用碱性滴定管盛放,待测液用锥形瓶盛放;根据题目所给3个化学方程式可得对应关系:Se ~ SeO2 ~ 2I2 ~ 4Na2S2O3,则粗硒样品中硒的质量分数=0.0276L×0.2000mol/L×1/4×79g/mol÷0.1200g×100%=90.85%
