(14分)近年来我国的航天事业取得了巨大的成就,在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1 g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式 。
⑵在实验室中,用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116 ℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
A.酒精灯
B.长直玻璃导管
C.锥形瓶
D.冷凝管 E.牛角管(接液管) F.蒸馏烧瓶 G.酸式滴定管
②除上述必需的仪器外,还缺少的玻璃仪器是 。
⑶肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1 mol Fe3O4,需要消耗肼的质量为 g。
⑷磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3. 。
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是 。
②若所得溶液显血红色,则假设 成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生 的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若产生 现象,则假设3成立。
⑴N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-64a kJ·mol-1
⑵ ①BG ②温度计 ⑶8 g (2,2,1,2)
⑷假设3:黑色粉末是CuO和Fe3O4的混合物
①溶液显蓝色 ②2或3 ③有红色固体析出
④红褐色沉淀 红褐色沉淀,同时溶液呈深蓝色 (1,1,1,1,1,2)
题目分析:⑴先根据题意写出反应方程式并标出各物质的状态:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g);然后计算出2 mol N2H4参加反应时的反应热 ΔH=-2×32×a=-64a kJ·mol-1,综上便可写出完整的热化学方程式;
⑵蒸馏装置中必须有铁架台、酒精灯、蒸馏烧瓶、温度计、冷凝管、牛角管(接液管) 、锥形瓶等;
⑶根据氧化还原反应的配平原则写出该反应方程式:N2H4+6Fe2O3=4Fe3O4+N2+2H2O,根据反应方程式知每生成1 mol Fe3O4,需要消耗肼的质量为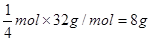 ;
;
⑷根据已知的两个猜想,很容易得出假设3:黑色粉末是CuO和Fe3O4的混合物。
①根据假设1(黑色粉末是CuO),取少量粉末放入足量稀硫酸中,反应生成硫酸铜溶液,在所得溶液中滴加KSCN试剂不与硫酸铜反应,但硫酸铜溶液本身为蓝色。
②若所得溶液显血红色,说明溶液中有Fe3+,即含有Fe3O4,故假设2或3成立;
③要说明假设3成立,即必须证明含有Cu2+,故继续向所得溶液加入足量铁粉,能与其反应生成红色固体(Cu)析出。
④根据信息,要证明即有CuO和Fe3O4,即加入稀硫酸后溶液中含有Fe3+、Cu2+,与足量氨水反应生成Fe(OH)3(红褐色沉淀)和Cu(NH3)42+(深蓝色溶液)。
考 点:本题以“肼(N2H4)”为素材,考查化学实验基础知识和化学实验的探究能力。热化学方程式的书写、蒸馏操作,化学计算(根据方程式),实验探究的假设与验证等。
