某同学设计如表所示实验,探究金属铜对H2O2分解速率的影响.
| 操作 | 装置 | 现象 |
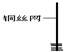
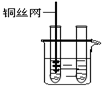
| 1、取一小块铜丝网,卷成筒形,固定在铜丝上. |
| |
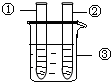
| 2、分别向①和②中注入15mL、30%的H2O2,并放入盛有热水的③中. |
| 约1min后可观察到① 和②中都有少量气泡产生 |
| 3、把铜丝插入①中. |
| ①中有大量气泡产生,约5min后不再有气泡产生;此时②中 仍然有少量气泡产生 |
(1)仪器的①名称是______,仪器③的名称是______;
(2)仪器②中实验的目的是______;
(3)根据上述实验,可以得出的结论是______;
(4)如果用本实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是______.
A.称量实验前铜丝网的质量 B.将实验后的铜丝网干燥、称重
C.向仪器中加入二氧化锰 D.将实验后的铜丝网再放在双氧水中
(5)产生大量气泡的实验原理(用文字表达式表示)______.
(1)可以直接写出仪器的名称为试管、烧杯;
(2)仪器①和仪器②加入的过氧化氢的浓度相同,但是仪器②中没有加入铜网,所以仪器②所起的作用是对照作用;
(3)把铜丝网固定在铜丝上,看到反应速率明显加快,说明金属铜能加快过氧化氢的分解速率;
(4)根据催化剂的定义可以知道,催化剂在反应前后质量和化学性质不变.我们可以称量实验前后铜丝网的质量,根据质量是否发生变化判断它是否是催化剂;
(5)过氧化氢分解生成氧气和水,文字表达式是:过氧化氢
水+氧气.催化剂
故答案为:(1)试管;烧杯;
(2)和①作对比(对照);
(3)金属铜能加快过氧化氢的分解速率;
(4)ABD.
(5)过氧化氢
水+氧气催化剂