为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
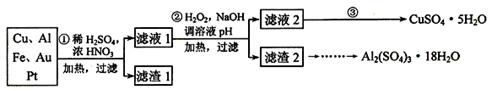
(1)第①步Cu与混酸反应的离子方程式为______________________________。得到滤渣1的主要成分为_________________。
(2)第②步中加入H2O2的作用是__________________,使用H2O2的优点是_________;调溶液pH的目的是____________________________________。
(3)简述第③步由滤液2得到CuSO4·5H2O的方法是_________________________
____________________________________________________________ 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案:
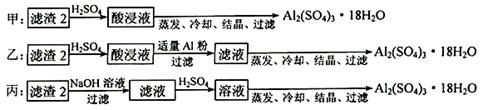
上述三种方案中,_______方案不可行,原因是_______________________________;
从原子利用率角度考虑,_______方案更合理。
(5)用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-→ CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω= __________________ 。
(1)Cu + 4H+ + 2NO3- =Cu2+ + 2NO2↑+ 2H2O或
3Cu + 8H+ + 2 NO3-=3Cu2+ + 2NO↑+ 4H2O(2分);Au、Pt(1分)
(2)将Fe2+氧化为Fe3+ (1分) 不引入杂质,对环境无污染(1分);
使Fe3+、Al3+沉淀除去(2分)
(3)加热滤液2,经过蒸发、冷却、 结晶、过滤 ,最终制得硫酸铜晶体(2分)
(4)甲 ,所得产品中含有较多Fe2(SO4)3杂质; 乙 (各1分,共3分)
(5)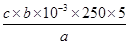 × 100% (2分)
× 100% (2分)
题目分析:(1)Cu与混酸反应的实质是与H+、NO3-反应,随反应进行离子浓度逐渐减小,所以离子方程式为Cu + 4H+ + 2NO3- =Cu2+ + 2NO2↑+ 2H2O,3Cu + 8H+ + 2 NO3-=3Cu2+ + 2NO↑+ 4H2O,Au、Pt不与混酸反应,所以滤渣的主要成分是Au、Pt;
(2)加过氧化氢的目的是把亚铁离子氧化成铁离子,方便除去;而且加入过氧化氢不会引入新的杂质且无污染;调节溶液的pH目的是使Fe3+、Al3+沉淀除去
(3)由滤液2得到CuSO4·5H2O的方法是把滤液蒸发得浓溶液再冷却结晶,过滤得硫酸铜晶体
(4)甲方案不可行,因为滤渣2的主要成分是Fe(OH)3、Al(OH)3沉淀,加入硫酸沉淀全部溶解使制得的产品中含有较多Fe2(SO4)3杂质; 从原子利用率角度分析,乙方案更合理,不仅能除去硫酸铁,同时增加了硫酸铝的量,原子利用率较高
(5)由滴定反应方程式得100ml溶液中n(Cu2+)=b×10-3×a×5mol,所以CuSO4·5H2O质量分数= b×10-3×a×5×250/a×100%
