(12分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
V.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
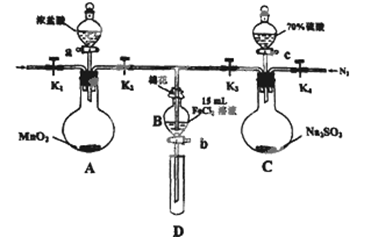
(1)过程Ⅰ的目的是______________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为__________________________________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________
(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作是________________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
| 过程IV B溶液中含有的离子 | 过程VI B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(1)排出装置中的氧气(空气);(2)氢氧化钠溶液;(3)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(4)70%的硫酸中的H+的浓度比98%的硫酸中的H+的浓度大;(5)取少量B溶液于试管中,加入足量的稀盐酸酸化,再滴加几滴氯化钡溶液,若有白色沉淀生成,证明溶液B中有硫酸根。(6)乙、丙。
题目分析:(1)根据题意可知:在过程I中通入过量的N2的目的是排出装置中的氧气(空气);以防止氧气影响离子的检验。(2)因为Cl2是大气污染物,为防止氯气对环境造成污染,用的棉花中浸润的溶液为NaOH溶液。(3)A是制取氯气的装置。A中发生反应的化学方程式为MnO2+4HCl(浓)  MnCl2 +Cl2↑+2H2O;(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,是因为在98%的硫酸中硫酸主要以分子的形式存在,而在70%的硫酸中有大量的硫酸分子发生电离,产生H+,即70%的硫酸中的H+的浓度比98%的硫酸中的H+的浓度大;所以离子浓度越大,反应速率就越快。(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作方法是取少量B溶液于试管中,加入足量的稀盐酸酸化,再滴加几滴氯化钡溶液,若有白色沉淀生成,证明溶液B中有硫酸根。(6)甲:发生反应:2Fe2++Cl2==2Cl-+2Fe3+;可能由于氯气过量,发生反应:Cl2+SO2+2H2O=SO42-+4H++2Cl-;只能证明:氧化性:Cl2> Fe3+;Cl2> SO2。而不能证明:Fe3 > SO2。错误。乙:发生反应:2Fe2++Cl2==2Cl-+2Fe3+;2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;证明氧化性Cl2> Fe3+> SO2。正确。丙:发生反应:2Fe2++Cl2==2Cl-+2Fe3+;由于SO2过量,所以发生反应2Fe3++SO2+2H2O=SO42-+4H++2Fe2+将所有的Fe3+还原为Fe2+;证明氧化性Cl2> Fe3+> SO2。正确。选项为乙、丙。
MnCl2 +Cl2↑+2H2O;(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,是因为在98%的硫酸中硫酸主要以分子的形式存在,而在70%的硫酸中有大量的硫酸分子发生电离,产生H+,即70%的硫酸中的H+的浓度比98%的硫酸中的H+的浓度大;所以离子浓度越大,反应速率就越快。(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作方法是取少量B溶液于试管中,加入足量的稀盐酸酸化,再滴加几滴氯化钡溶液,若有白色沉淀生成,证明溶液B中有硫酸根。(6)甲:发生反应:2Fe2++Cl2==2Cl-+2Fe3+;可能由于氯气过量,发生反应:Cl2+SO2+2H2O=SO42-+4H++2Cl-;只能证明:氧化性:Cl2> Fe3+;Cl2> SO2。而不能证明:Fe3 > SO2。错误。乙:发生反应:2Fe2++Cl2==2Cl-+2Fe3+;2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;证明氧化性Cl2> Fe3+> SO2。正确。丙:发生反应:2Fe2++Cl2==2Cl-+2Fe3+;由于SO2过量,所以发生反应2Fe3++SO2+2H2O=SO42-+4H++2Fe2+将所有的Fe3+还原为Fe2+;证明氧化性Cl2> Fe3+> SO2。正确。选项为乙、丙。
