某混合金属粉末,除Fe外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在,探究过程如下:
【查阅资料】①Zn可以与NaOH溶液反应生成H2
②Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O
③Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸生成Zn2+、NH4+
【提出假设】假设①:该混合金属粉末中除Fe外还含有Al元素
假设②:该混合金属粉末中除Fe外还含有Zn元素
假设③:该混合金属粉末中除Fe外还含有Al、Zn元素
【实验探究】所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
甲同学基于假设③设计实验方案如下:

乙同学同样基于假设③设计另一实验方案如下:
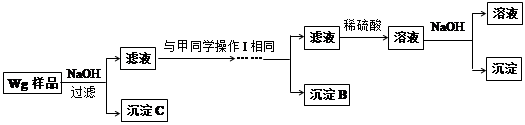
(1)Fe元素在周期表中的位置是第 周期 族。
(2)试剂M是 ;沉淀B是 。
(3)你认为甲、乙同学的方案 (填“甲”或“乙”)比较好,理由是 。
(4)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,你认为 (填“是”或“否”)准确,原因是 。
(6)电解法制金属铝的化学方程式是 。
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
(1)第四周期 VIII族(2)NaOH Al(OH)3 (3)乙 步骤简单,节约药剂。(4)稀硫酸 氨水
(5)不合理,C沉淀为氢氧化铁,经洗涤、烘干、冷却后得到为氧化铁,并非Fe的质量。
(6)2Al2O3(熔融) 4Al+3O2↑ (7)Al+3NiO(OH) +H2O+NaOH = 3Ni(OH)2+NaAlO2
4Al+3O2↑ (7)Al+3NiO(OH) +H2O+NaOH = 3Ni(OH)2+NaAlO2
题目分析:根据甲同学基于假设③设计实验方案,样品加入酸之后生成了铁盐、铝盐和锌盐,铁盐加过量的强碱生成了沉淀不溶解,而铝盐和锌盐加过量的强碱先生成了沉淀然后沉淀溶解;而铁盐、铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,锌盐加过量的弱碱先生成了沉淀然后沉淀溶解,由实验方案可知铁盐、铝盐和锌盐形成的沉淀分三次分离,第一次为:Fe(OH)2,试剂M为NaOH溶液,第二次为:Al(OH)3,铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)3沉淀的分离;第三次为Zn(OH)2,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入适量的NaOH溶液,形成沉淀;(1)铁为第26号元素,故为第四周期 VIII族。(2)根据上述分析可知试剂M是NaOH,沉淀B为Al(OH)3。(3)两同学中乙同学步骤简单,节省药品。(4)操作Ⅰ的主要过程是:在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入足量的氨水。(5)不合理,C沉淀为氢氧化铁,经洗涤、烘干、冷却后得到为氧化铁,并非Fe的质量。(6)电解铝的反应方程式为2Al2O3(熔融) 4Al+3O2↑。(7)电池反应的化学方程式是Al+3NiO(OH) +H2O+NaOH = 3Ni(OH)2+NaAlO2
4Al+3O2↑。(7)电池反应的化学方程式是Al+3NiO(OH) +H2O+NaOH = 3Ni(OH)2+NaAlO2
