(15分)
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
NaBr+H2SO4 HBr+NaHSO4
HBr+NaHSO4
CH3CH2OH+HBr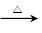 CH3CH2Br+H2O
CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如右图的装置。
根据题意完成下列填空:有关数据列表如下:
| 乙醇 | 溴乙烷 | |
| 状态 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -l30 | 38.4 |
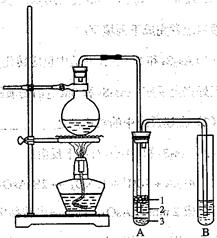
(1)圆底烧瓶中加入的反应物是溴化钠、 和2:1的硫酸。配制体积比2:1的硫酸所用的仪器为 (选填编号)
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶 e.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,试管A中的物质分为三层(如图所示),产物在第
层;
(3)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质应加
入 (选填编号)然后再进行 一步操作即可;
a.无水氯化钙 b.硝酸银溶液 c.四氯化碳 d.亚硫酸钠溶液
(4)实验过程中,同学发现仪器连接部分有漏气现象,老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: ;
(5)假设最初取用的无水乙醇是57.5mL,最后得到的纯净的溴乙烷是52.0mL,则溴乙烷的产率为 。
(1)无水乙醇(2分),abc(3分) (2)3 (2分)
(3)d(2分),分液 (2分) (4)反应会产生Br2,腐蚀橡胶(2分) (5)66.8%(2分)
题目分析:(1)根据题目所给信息,反应物还需要有无水乙醇,所以圆底烧瓶中加入的反应物除了NaBr和硫酸,还要加入无水乙醇;配制体积比2:1的硫酸需要量筒量取浓硫酸和水的同体积,需要在烧杯中溶解,并用玻璃杯搅拌,故答案为abc。
(2)溴乙烷的密度最大,在最底层,即第3层。
(3)试管A中获得的有机物呈棕黄色,说明生成了Br2,Br2具有氧化性,可用亚硫酸钠溶液除去;Br2与亚硫酸钠溶液反应的生成物均溶于水,所以通过分液即可完成除杂。
(4)浓硫酸氧化Br‾生成Br2,Br2具有腐蚀性,能腐蚀橡胶,所以把器连接部分都改成标准玻璃接口。
