(10分)某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):__________。
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 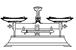 | 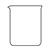 |  |  |  |  |
| 序号 | a | b | c | d | e | f |
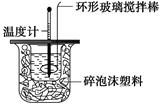
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_________________________
________________________________________________________________________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
 温度 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
44.Ⅰ.(1)5.0(2)abe
Ⅱ.(1)H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l)ΔH=-114.6 kJ·mol-1
(2)①4.0②-53.5 kJ·mol-1③acd
题目分析:(1)245ml的溶液,需要配制250ml的溶液,故需要根据体积250mL算出所需氢氧化钠的质量;(2)氢氧化钠需放到小烧杯中称量,故用到天平、小烧杯和钥匙;II(1)中和热是指生成1molH2O放出的热量,故生成2molH2O时放出的热量也加倍;(2)①终止温度减去起始温度平均值,算出每次的温度差,再求四次的平均值;②比热容乘以溶液的质量得热量,再算出生成1mol水放出的热量换算成kJ即得中和热;③b选项量取氢氧化钠时仰视读数会使所取氢氧化钠体积增大,放出热量增多,故b错误;ac均是热量有损失,故正确;d是温度计上附着的氢氧化钠和硫酸反应了,这部分热量损失了;故选acd。
