某学校化学兴趣小组为探究金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的AlCl3溶液和胆矾晶体(CuSO4∙5H2O),其实验方案如下:
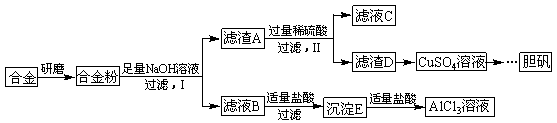
请回答下列问题:
(1)将合金研磨成合金粉的目的是 。
(2)分别写出步骤Ⅰ、Ⅱ中发生反应的化学方程式:
Ⅰ: ;
Ⅱ: 。
(3)在滤液B转化为沉淀E的过程中盐酸的用量不易控制,可将加入适量的盐酸改为通入一种气体,该气体的电子式为 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式: 。
(4)该小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2可制得CuSO4,该反应的总化学方程式为 。
(1)增大反应物的接触面积,使反应速率加快(或使反应更充分)
(2)Ⅰ:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ Ⅱ:Fe+H2SO4=FeSO4+H2↑
(3)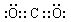 [Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
(4)Cu+H2O2+H2SO4=CuSO4+2H2O
题目分析:由流程图可知合金中加入NaOH溶液发生反应为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑故滤液B中含有Na[Al(OH)4]和NaOH,滤渣A中含有铁和铜,滤液B中加入适量盐酸生成的沉淀E为Al(OH)3
(1)增大反应物的接触面积,使反应速率加快(或使反应更充分)
(2)Ⅰ:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ Ⅱ:Fe+H2SO4=FeSO4+H2↑
 (3)由[Al(OH)4]-制最好加入弱酸,因Al(OH)3不溶于弱酸,故通入气体为CO2,故答案为:
(3)由[Al(OH)4]-制最好加入弱酸,因Al(OH)3不溶于弱酸,故通入气体为CO2,故答案为: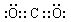 [Al(OH)4]-+CO2 Al(OH)3↓+HCO3-
[Al(OH)4]-+CO2 Al(OH)3↓+HCO3-
 (4)Cu+H2O2+H2SO4 CuSO4+2H2O
(4)Cu+H2O2+H2SO4 CuSO4+2H2O
