问题
填空题
工业生产的氢氧化钠常含有碳酸钠杂质。为测定某样品中氢氧化钠纯度,设计以下实验。(装置气密性良好,每一步骤反应完全,浓H2SO4具有吸水性)
【实验设计】
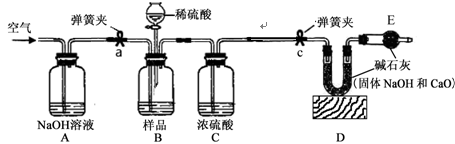
【实验过程】
(1)打开弹簧夹a,先对装置A、B、C(已连接)通入空气一会儿,以排尽装置含有的 ,再关闭弹簧夹a,接上装置D和E,打开弹簧夹c,把硫酸滴入样品中。
(2)反应结束后,待装置冷却后直接称量装置 (填字母序号)。根据该装置在反应前后的质量差得到CO2的质量,由此计算出该样品中碳酸钠的质量,最后得到样品中氢氧化钠纯度。
【数据分析】
最后计算得到样品中氢氧化钠纯度比实际数据偏大,反思整个实验过程,造成误差可能的原因 。
答案
(1)CO2
(2)D
【数据分析】B、C装置和导气管中CO2没有被D碱石灰吸收
题目分析:打开弹簧夹a,先对装置A、B、C(已连接)通入空气一会儿,以排尽装置含有的二氧化碳,二氧化碳会对后面的实验造成影响,稀硫酸与样品反应会有二氧化碳产生,通过测定产生的二氧化碳的质量来测定样品中碳酸钠的质量分数,从而测定氢氧化钠的分数,产生的二氧化碳会被D装置中的碱石灰吸收,D装置在反应前后的质量差即为二氧化碳的质量,所以应称量D装置的质量,实验结果偏大,则二氧化碳的质量偏大,所以原因可能是装置中二氧化碳有残留即B、C装置和导气管中CO2没有被D碱石灰吸收。
