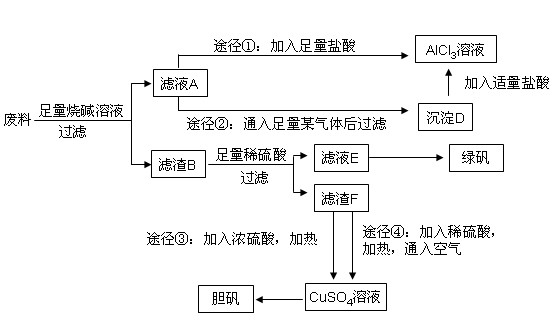
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
(1)写出合金与烧碱溶液反应的离子方程式: 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体(固态时可用于人工降雨),写出该气体的电子式 。你认为较合理的途径是 (填①或②),理由是: 。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了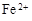 和
和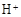 外,还可能存在 (用离子符号表示),检测该离子的方法是 。
外,还可能存在 (用离子符号表示),检测该离子的方法是 。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是: 、 。
(5)途径④发生的反应的化学方程式为: 。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、 、自然干燥。
(1)2Al +2OH― + 2H2O = 2AlO2― +3H2↑ (2分)
(2)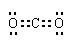 (1分) ② (1分) 途径①制取的AlCl3溶液中混有NaCl杂质(1分)
(1分) ② (1分) 途径①制取的AlCl3溶液中混有NaCl杂质(1分)
(3)Fe3+ (1分) 取样,滴加KSCN,若变血红色,则有Fe3+ 。(1分)
(4)成本低 (1分,合理给分,后同) ;不产生有毒气体 (1分)
(5)2Cu +2H2SO4 +O2→ 2CuSO4 +2H2O (2分)
(6)过滤洗涤 (1分)
题目分析:
(1)铝、铁、铜只有铝与烧碱溶液反应。
(2)与NaAlO2反应生成Al(OH)3,固态时可用于人工降雨,气体是CO2 ;NaAlO2 +4HCl=AlCl3+NaCl+2H2O 所以AlCl3溶液中混有NaCl杂质。
(3)Fe2+被空气氧化成Fe3+;Fe3+与KSCN反应,变血红色而Fe2+不能。
(4)途径③Cu+2H2SO4= CuSO4+ SO2↑+2H2O
途径④ 2Cu +2H2SO4 +O2 = 2CuSO4 +2H2O途径④用稀H2SO4成本低,不产生有毒气体
