(16分)Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(将表中序号处应填内容)。
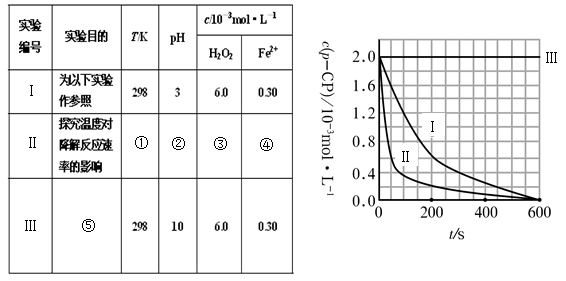
① ② ③ ④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为 ;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率 (填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时, ;
(3)可通过反应Fe3+ + SCN— Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
(1)① 313 ② 3 ③ 6.0 ④ 0.30 (各1分)
(以下每空2分)
⑤ 探究pH对降解速率的影响
(2)4.8×10-6 mol/(L·s) (若数值正确,不写单位或单位错误给1分)
80%(或0.8) 增大 降解速率为0
(3) 170 L/mol 或170 (mol/L)-1 (只要数值正确,写不写单位均给满分)
(1)对比实验的基本思想是控制变量法,可以在温度相同时,变化浓度,或者在浓度相等时,变化温度;
(2)a、根据反应速率公式v=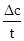 ,,降解率=
,,降解率= ×100%来计算;
×100%来计算;
b、根据实验①②的数据来回答;
c、在pH=10时,根据降解率= ×100%来计算;
×100%来计算;
(3)反应Fe3++SCN- Fe(SCN)2+的平衡常数K=
Fe(SCN)2+的平衡常数K=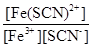 来计算。
来计算。
解;(1)对比实验的基本思想是控制变量法,温度相同时,变化浓度,在浓度相等时,变化温度,故答案为:313;3;6.0;0.30;探究pH对降解速率的影响;
(2)a.应在50-300s内的平均反应速率v(p-CP)=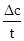 =
=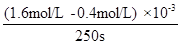 =
=
4.8×10-6 mol?L-1?s-1,300s时p-CP的降解率=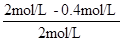 ×100%=80%,故答案为:4.8×10-6mol?L-1?s-1;80%;
×100%=80%,故答案为:4.8×10-6mol?L-1?s-1;80%;
b.根据实验数据内容可以看出温度升高,降解反应速率增大,故答案为:增大;
c.根据实验数据内容可以看出pH=10时,降解速率为零,故答案为:零;
(3)反应Fe3++SCN- Fe(SCN)2+的平衡常数K=
Fe(SCN)2+的平衡常数K=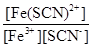 =
=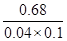 =170L/mol。
=170L/mol。
故答案为170。
