问题
填空题
已知铜在常温下能被浓HNO3溶解,反应的化学方程式为Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O
(1)标出上面反应中的电子转移情况.______
(2)反应中生成1mol NO2,则被还原HNO3的物质的量为______.
答案
(1)Cu+4HN03═Cu(N03)2+2NO2↑+2H20中,Cu元素的化合价由 0升高为+2价,N元素的化合价由+5价降低为+4价,该反应中转移2mol电子,则电子转移的方向和数目为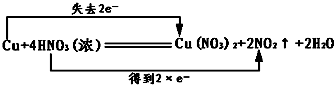 ,
,
故答案为: ;
;
(2)由反应可知,生成1mol气体就有1mol硝酸被还原,则反应中生成1mol NO2,则被还原HNO3的物质的量为1mol,
故答案为:1mol.
