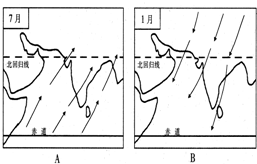
将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,进而向所得溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液体积(mL)的图示如下.下列分析的结论中正确的是( )
A.溶解“一定量Mg、Al合金”的HCl溶液的体积小于80mL
B.由题中数据,无法求出实验中产生H2的物质的量
C.无法确定Mg、Al合金中n(Mg)/n(Al)的最大值
D.欲求出a的取值范围尚缺少一个条件
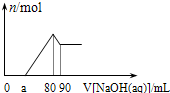
根据图可知,首先发生的反应是中和过量的酸:H++OH-=H2O,然后是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、
Al3++3OH-=Al(OH)3↓,最后是Al(OH)3的溶Al(OH)3+OH-=[Al(OH)4]-,从横坐标80mL到90mL这段可以求出
n(Al(OH)3)=0.01mol,则n(Al)=n(Al(OH)3)=0.01mol,所以沉淀Al3+需要的OH-为0.03mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为80-a,若假设盐酸不剩,所以沉淀Mg2+需要NaOH溶液的体积最大值为50mL,求出n (Mg)的最大值为0.025mol,所以该合金中镁铝两元素物质的量之比的最大值为2.5,故C错误,
0.01mol的金属铝消耗盐酸为0.03mol,当金属镁的最大物质的量为0.025mol时,消耗盐酸的最大量是0.05mol,所以溶解金属镁、铝所需HCl溶液的体积小于或者是等于80mL,故A错误;
金属镁的量不确定,无法判断生成氢气的量的多少,故B正确,
假设盐酸溶解金属后不剩,这种情况下,酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为 0≤a<50,故D错误.
故选B.