小亮对课本中C和CuO反应的产物进行了进一步的探究,以下是他进行实验的部分流程(装置气密性良好)
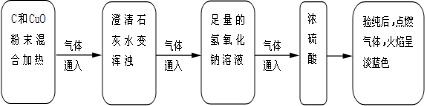
(1)通过以上实验,可知产物中有______气体.
(2)取出反应后的固体,观察呈红色.
【查阅资料】①C也能将CuO还原为红色固体Cu2O(氧化亚铜);②Cu2O+H2SO4(稀)=Cu+CuSO4+H2O;
【猜想】
(a)红色固体只是Cu
(b)______
(c)红色固体是Cu和Cu2O的混合物
【实验探究】
| 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| 取7.2g红色固体,置于烧杯中,向其中加入足量稀硫酸,充分搅拌,静置. | 若无现象. | 证明红色固体______. |
| 若______ | 证明红色固体肯定含有______,可能含有______. | |
| 取上述反应液过滤、洗涤、干燥和称量,得固体6.8g. | 确认红色固体是______. |
(1)澄清石灰水变浑浊,说明反应生成了气体二氧化碳;气体点燃,火焰呈淡蓝色,根据质量守恒定律,可推断气体为一氧化碳;
故答案为:CO2和CO;
【猜想】C在高温条件与CuO反应可生成红色Cu或Cu2O,所以,反应后得到的红色固体可能是铜,也可能是氧化亚铜,还可能为铜与氧化亚铜的混合物;
故答案为:红色固体只是Cu2O;
【实验探究】根据铜不能与稀硫酸反应而Cu2O却可与稀硫酸生成铜、硫酸铜和水,把红色固体放入稀硫酸中,无明显变化时,红色固体全部为铜;红色固体部分消失且反应后的溶液呈蓝色,红色固体一定含有Cu2O,而未溶解的红色铜可能是原有的也可能是Cu2O与酸反应生成的,因此可判断红色固体中可能含有铜;
假设7.2g红色固体全部为Cu2O,则其中含Cu元素质量=7.2g×
×100%=6.4g<6.8g,所以7.2g红色固体全部为Cu2O的假设不成立,则7.2g红色固体为Cu和Cu2O的混合物;64×2 144
故答案为:
| 实验操作 | 实验现象 | 实验结论 |
| Cu | ||
| 固体部分溶解,溶液变成蓝色 | 肯定含有Cu2O;可能含有Cu | |
| Cu和Cu2O的混合物 |
