根据反应8NH3+3Cl2═6NH4Cl+N2,回答下列问题:
(1)用双线桥表示出该电子转移的数目和方向
(2)氧化剂是______,被氧化的元素是______,还原剂与还原产物的质量比是______.
(3)当有34gNH3参加反应时,被氧化的物质的质量为______g,生成的还原产物的质量为______g.
(1)失电子的N元素化合价升高,得电子的Cl元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目=6,电子转移情况为: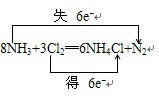 ,故答案为:
,故答案为: ;
;
(2)该氧化还原反应中,失电子的N元素化合价升高,被氧化,所在反应物NH3是还原剂,对应产物N2是氧化产物,得电子的Cl元素化合价降低,所在反应物Cl2是氧化剂,对应产物NH4Cl是还原产物,还原剂NH3与还原产物NH4Cl的物质的量之比是2:6=1:3,质量比为:(1×17):(53.5×3)=34:321,故答案为:Cl2;N;34:321;
(3)该氧化还原反应中,被氧化的氨气的物质的量和参加反应的氨气的物质的量之比为:1:4,当有34gNH3参加反应时,被氧化的氨气的质量为:
=8.5g,根据化学方程式,设生成的氯化铵的质量为m,则34g 4
8NH3+3Cl2═6NH4Cl+N2
17×8 6×53.5
34g m
=17×8 34g 53.5×6 m
解得m=80.25g.
故答案为:8.5;80.25.
