Fe和Al是两种常见的金属,将它们按一定的质量比组成混合物.
(1)取一定质量的该混合物,向其中加入足量NaOH溶液,生成气体在标准情况下的体积为aL,则反应的离子方程式为______;混合物中Al的物质的量为______(用含字母的数学式表示).
(2)另取相同质量的混合物,向其中加入足量稀硫酸,固体全部溶解,生成气体在标准状况下的体积为bL,则反应中转移电子的物质的量为______;混合物中Fe的质量为______(用含字母的数学式表示).
(1)铁和氢氧化钠不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
设铝的物质的量为x,
2Al+2OH-+2H2O=2AlO2-+3H2↑
2mol 67.2L
x aL
x=
=2mol×aL 67.2L
mol5a 193
混合物中Al的物质的量为
mol,5a 193
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
mol;5a 193
(2)该反应中转移电子数等于氢离子得到的电子数=
mol×2=b 22.4
mol,相同质量的铝与足量稀硫酸或氢氧化钠反应生成的氢气体积相同,所以等质量的铝和稀硫酸反应生成氢气的体积是aL,则铁与稀硫酸反应生成氢气的体积=(b-a)L,5b 56
设铁的质量是y,
Fe+H2SO4=FeSO4+H2↑
56g 22.4L
y (b-a)L
y=
=2.5(b-a)g,56g×(b-a)L 22.4L
即转移电子的物质的量是
mol,铁的质量是2.5(b-a)g,5b 56
故答案为:
mol;2.5(b-a)g.5b 56

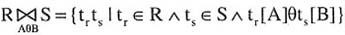 表示的是( )。
表示的是( )。