某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验.
(1)如何检验该装置的气密性______.
(2)合金样品固体M与氢氧化钠溶液反应的离子方程式______.
(3)倾斜左边装置使氢氧化钠溶液(足量)与ag合金粉末(固体M)充分反应,待反应停止后,进入量气管气体的体积为VmL(已折算成标准状况).若量气管最大量程为50mL.,则固体M中铝的质量(mA1)范围为______.
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积______ (填“>”“<”“=”)VmL.
(5)若a=38mg,V=44.8mL(标准状况),请通过计算说明该合金是否符合国家标准(不写计算过程)______ (填“符合”或“不符合”).
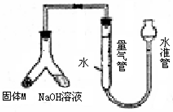
(1)检验装置的气密性常用方法为利用气体的热胀冷缩或液封气体形成液面高度差,由装置图可知适合选择液封气体形成液面高度差,检验该装置气密性的方法为:安装好装置并在量气管内加人水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装量密封,
故答案为:安装好装置并在量气管内加人水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装量密封;
(2)铝与氢氧化钠、水反应生成四羟基合铝酸钠、氢气,反应离子方程式为2OH-+2Al+6H2O═2[Al(OH)4]-+3H2↑,
故答案为:2OH-+2Al+6H2O═2[Al(OH)4]-+3H2↑;
(3)量气管最大量程为50mL,则产生氢气的增大体积为50mL,所以氢气的最大物质的量为
=0.05L 22.4L/mol
mol,根据电子转移守恒可知3n(Al)=2n(H2)=0.05 22.4
mol×2,故铝的最大质量为0.05 22.4
×1 3
mol×2×27g/mol=0.04g,所以金属铝的质量范围为0<mAl<0.04g,0.05 22.4
故答案为:0<mAl<0.04g;
(4)Mg、Al都与盐酸反应生成氢气,改用盐酸生成氢气的体积增大,故答案为:>;
(5)44.8mL氢气的物质的量为
=0.002mol,根据电子转移守恒可知3n(Al)=2n(H2)=0.002mol×2=0.004mol,所以合金中铝的质量0.0448L 22.4L/mol
×0.004mol×27g/mol=0.036g,合金中Al的质量分数为1 3
×100%=94.74%>78%,故该合金符合标准,故答案为:符合.0.036g 0.038
