问题
选择题
有200mL氯化镁和氯化铝的混合溶液,其中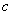 (Mg2+)为0.2mol・L-1,
(Mg2+)为0.2mol・L-1,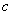 (Cl-)为1.3mol・L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol・L-1NaOH溶液的体积为( )
(Cl-)为1.3mol・L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol・L-1NaOH溶液的体积为( )
A.40mL
B.72mL
C.80mL
D.128mL
答案
答案:C
欲使Mg2+全部转化成沉淀并从溶液中分离出来,应向溶液中加入过量的NaOH溶液,使Mg2+、Al3+全部沉淀后,再使Al(OH)3恰好溶解。设c(Al3+)=x,根据电荷守恒,则有:
3x+2c(Mg2+)=c(Cl-),即3x+2×0.2 mol·L-1="1.3" mol·L-1,解得x="0.3" mol·L-1。设NaOH溶液的体积为V,根据关系式则有:
Mg2+ — 2OH-
0.2 mol·L-1×0.2 L 2×0.2 mol·L-1×0.2 L
Al3+ — 4OH-
0.3 mol·L-1×0.2 L 4×0.3 mol·L-1×0.2 L
得2×0.2 mol·L-1×0.2 L+4×0.3 mol·L-1×0.2 L=4×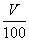 ,即V="80" mL。
,即V="80" mL。
