下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
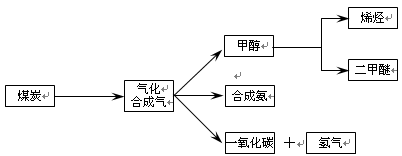
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应反应的化学方程式为 。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g)  2CO(g),K1
2CO(g),K1
CO(g)+H2O(g)  H2(g)+CO2(g),K2
H2(g)+CO2(g),K2
C(s)+H2O(g) 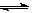 CO(g)+H2(g),K3
CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(3)对于反应N2O4(g) 2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
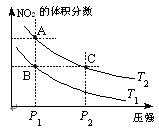
A.两种不同的温度比较:T1 > T2
B.A、C两点的反应速率:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法实现
(4)如右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g) + NO2(g) + 2NH3(g) 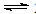 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)
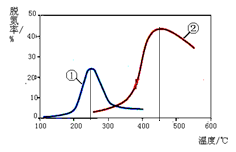
 以下说法正确的是(注:脱氮率即氮氧化物转化率)
以下说法正确的是(注:脱氮率即氮氧化物转化率)
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.催化剂①、②分别适合于250℃和450℃左右脱氮
(1)(2分)C(s)+H2O(g)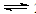 CO(g)+H2(g) K3=K1?K2
CO(g)+H2(g) K3=K1?K2
(2)(2分)吸热,75% (各1分)
(3)(2分)B、D (一个1分,错一个扣2分)
(4)(2分)D
(1)平衡常数的定义为:可逆反应达到平衡后,生成物浓度幂之积与反应物浓度幂之积的比值。所以,由平衡常数表达式K=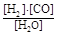 可知:对应的方程式为:C(s)+H2O(g)
可知:对应的方程式为:C(s)+H2O(g)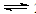 CO(g)+H2(g);
CO(g)+H2(g);
由方程式C(s)+CO2(g) 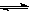 2CO(g),K1①;CO(g)+H2O(g)
2CO(g),K1①;CO(g)+H2O(g) 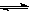 H2(g)+CO2(g),K2②;
H2(g)+CO2(g),K2②;
C(s)+H2O(g) 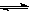 CO(g)+H2(g),K3 ③;得将①+②=③,即可知K1、K2、K3之间的关系为K3=K1?K2;
CO(g)+H2(g),K3 ③;得将①+②=③,即可知K1、K2、K3之间的关系为K3=K1?K2;
(2)由表中平衡常数与温度的关系:温度越高K越小,即可知逆反应方向的反应为吸热反应;
由方程式:CO(g) + H2O(g) 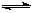 H2(g) + CO2(g),
H2(g) + CO2(g),
起始浓度:0.020mol/L 0.020mol/L 0 0
变化浓度: x x x x
平衡浓度:0.020-x 0.020-x x x
500℃时平衡常数K=9=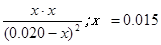 ;平衡时CO的转化率
;平衡时CO的转化率
 ;
;
(3)由方程式N2O4(g)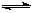 2NO2(g);△H=Q(Q>0),温度越高,NO2(g)的含量越高,即T2 > T1,A错;相同温度下,压强越大,体积越小,气体的浓度越高,反应速率越快,所以A、C两点的反应速率:A<C,B正确;B、C两点NO2(g)的体积分数相同,即B、C两点的气体的平均相对分子质量:B=C,C错;B→A的过程中NO2(g)的的体积分数增大,可用加热的方法实现,D正确;
2NO2(g);△H=Q(Q>0),温度越高,NO2(g)的含量越高,即T2 > T1,A错;相同温度下,压强越大,体积越小,气体的浓度越高,反应速率越快,所以A、C两点的反应速率:A<C,B正确;B、C两点NO2(g)的体积分数相同,即B、C两点的气体的平均相对分子质量:B=C,C错;B→A的过程中NO2(g)的的体积分数增大,可用加热的方法实现,D正确;
(4)由于反应为:NO(g) + NO2(g) + 2NH3(g) 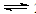 2N2(g) + 3H2O(g),由图像可知,相同条件下,开始时随温度的升高脱氮率逐渐增大,后随温度的升高脱氮率逐渐减小;最高点表示达到平衡状态,平衡后再升高温度脱氮率反而是减小的,所以,该反应的正反应方向为放热反应,A错;该反应为非等体积反应,压强的改变必须会影响脱氮率,所以B错;曲线①、②最高点表示反应达到平衡状态,C错;由图形分析可知催化剂①、②分别适合于250℃和450℃左右脱氮,D正确;
2N2(g) + 3H2O(g),由图像可知,相同条件下,开始时随温度的升高脱氮率逐渐增大,后随温度的升高脱氮率逐渐减小;最高点表示达到平衡状态,平衡后再升高温度脱氮率反而是减小的,所以,该反应的正反应方向为放热反应,A错;该反应为非等体积反应,压强的改变必须会影响脱氮率,所以B错;曲线①、②最高点表示反应达到平衡状态,C错;由图形分析可知催化剂①、②分别适合于250℃和450℃左右脱氮,D正确;