问题
计算题
由铝和某种金属A组成的混合物,将它分成二等份,一份放入过量的盐酸中,混合物完全溶解,放出H2共12.32L(标准状况),溶液质量增加了9.7g,另一份放入过量烧碱溶液中,充分反应后放出H2共8.96L(标准状况),溶液质量增加了6.4g,而某金属A不反应,试推断未知金属A。
答案
A∶Mg
定量确定元素种类,通常采用计算原子量与化合价的比值,然后再讨论确定的方法。设A金属的原子量为M,化合价为n,则:
2Al+6HCl=2AlCl3+3H2↑ ①
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ②
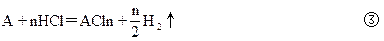
比较①、②、③可知:A与盐酸反应放出的氢气应为:
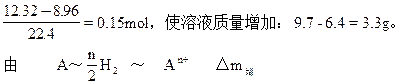
n M (M-n)
0.15×2 3.3
得 0.3(M-n)= 3.3n即 M=12n
讨论:当 n=+1时, M=12(无此种金属)
当 n=+2时, M= 24(Mg)
当n=+3时,M=36(无此种金属)
故符合题意的只能是镁。
