问题
选择题
镁条在空气中燃烧生成氧化镁和氮化镁,将燃烧产物溶于60 mL浓度为 2 mol·L-1的盐酸中,以20 mL浓度为0.5 mol·L-1的氢氧化钠溶液中和多余的盐酸,然后在溶液中加入过量的氢氧化钠溶液,并加热使氨气全部挥发,再用稀盐酸吸收氨气,使此盐酸增重0.17 g,求镁条的质量。
〔已知:Mg3N2+6H2O====3Mg(OH)2+2NH3〕
答案
1.2 g
图4-8
3Mg+N2====Mg3N2
Mg3N2+8HCl====3MgCl2+2NH4Cl
NH4Cl+NaOH NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
3Mg~Mg3N2~8HCl~2NH3
3 8 2
0.015 mol 0.04 mol 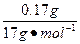 ="0.01" mol
="0.01" mol
Mg ~ MgO ~ 2HCl
1 2
0.035 mol 0.06 L×2 mol·L-1-0.04 mol-
0.02 L×0.5 mol·L-1="0.07" mol
m(Mg)="(0.015" mol+0.035 mol)×24 g·mol-1="1.2" g
也可采用电荷守恒法。
