有铝和四氧化三铁组成的铝热剂粉末,在隔绝空气中的条件下引燃,使之充分反应,把所得混合物研细,并分成两等份,分别投入到过量烧碱溶液和盐酸中,充分反应后,前者消耗氢氧化钠mmol,放出标准状况下的气体0.672L;后者消耗盐酸nmol,放出标准状况下气体VL。若将等质量的这种铝热剂中的铝粉和足量的稀硫酸反应,可以得到标准状况下的气体6.72L。
(1)铝热剂中各成分的质量分数。
(2)m、n、V的值各是多少?
(1)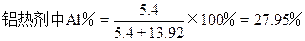
Fe3O4%=1-27.95%=72.05%
(2) m=0.10(mol)
N =0.48(mol)
V =2.688(L)
题目没有指明铝热剂中铝粉和四氧化三铁各自的质量分数,那么铝粉和四氧化三铁混合有三种情况:①铝粉和四氧化三铁适量,恰好两者完全反应,反应物无剩余,产物是三氧化二铝和单质铁,该混合物投入过量的氢氧化钠溶液中,铁跟氢氧化钠溶液不反应,三氧化二铝跟氢氧化钠溶液反应,但是不放出气体,不合题意;②铝热剂中四氧化二铁过量,反应后的混合物中有三氧化二铝、铁和剩余的四氧化三铁,将其混合物投入过量的氢氧化钠溶液中,铁和四氧化三铁跟氢氧化钠溶液都不反应,三氧化二铝跟氢氧化钠反应,但是不放出气体,不合题意;③铝热剂中铝粉过量,反应后混合物中有三氧化二铝和剩余的铝,将其混合物投入过量的氢氧化钠溶液中,铁跟氢氧化钠不反应,三氧化二铝和铝都能跟氢氧化钠溶液反应,而且铝在反应时能够放出氢气,符合题意。
(1)求铝热剂中各成分的质量分数。
设原铝热剂中含xg。
2Al+3H2SO4=Al2(SO4)3+3H2↑
2×27g 3×22.4L
xg 6.72L
2×7∶x=3×22.4∶6.72
解得x=5.4(g)
设铝热反应后剩余的铝为yg。
2Al+2NaOH=2H2O=2NaAlO2+3H2↑
2×27g 3×22.4L
yg 0.672L
2×27∶y=3×22.4∶0.672
解得 y=0.54(g)
故参加铝热反应的铝粉为5.4-0.54×2=4.32(g)
设铝热剂中四氧化三铁的质量为zg
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
8×27g 3×232 4mol 9mol
4.32g zg b="0.08mol " c=0.18mol
8×27∶4.32=3×232∶z
解得z=13.92(g)
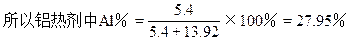
Fe3O4%=1-27.95%=72.05%
(2)求m、n和V
反应后每份反应后的混合物含铝0.54g,含铁0.18/2=0.09(mol)含三氧化二铝0.08/2=0.04(mol)
Al2O3 + 2NaOH=2NaAlO2+H2O
1mol 2mol
0.04mol 0.08mol
所以m=0.02+0.08=0.10(mol)
2Al + 6HCl = 2AlCl3 + 3H2↑
2×27g 6mol 3×22.4L
0.54g 0.06mol 0.672L
Fe + 2HCl =" " FeCl2 + H2↑
1mol 2mol 22.4L
0.09mol 0.18mol 22.4×0.09L
Al2O3 + 6HCl=2AlCl3+3H2O
1mol 6mol
0.04mol 6×0.04mol
所以n=0.06+0.18+0.24=0.48(mol)
V=0.672+22.4×0.09=2.688(L)
FM |
