问题
选择题
将铁、铝、硅的混合物分为等质量的两份,一份跟足量的NaOH溶液反应,另一份跟足量稀H2SO4反应,最终产生的H2一样多,则铁与硅物质的量之比为( )
A.2∶1
B.4∶1
C.1∶1
D.3∶1
答案
答案:A
本题结合铁、铝、硅的化学性质,考查化学计算方法与技巧,设每份混合物中含Fe、Al、Si的物质的量分别为x、y、z,列如下关系式:
与NaOH反应:Al ~ 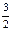 H2 Si~2H2
H2 Si~2H2
1 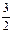 1 2
1 2
y  y z 2z
y z 2z
与HCl反应:Al ~ 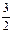 H2 Fe ~ H2
H2 Fe ~ H2
1 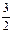 1 1
1 1
y 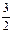 y x x
y x x
∵Al与NaOH反应放出的H2量=与HCl反应放出的H2量,
∴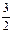 y+2z=
y+2z=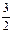 y+x, ∴2z=x, ∴ x∶z=2∶1。
y+x, ∴2z=x, ∴ x∶z=2∶1。
技能空间:等质量的铝分别与足量稀H2SO4和NaOH溶液作用的化学方程式为:
2Al + 3H2SO4══Al2(SO4)3 + 3H2↑
2Al + 2NaOH+2H2O══2NaAlO2 + 3H2↑
由反应方程式可知,等质量的铝产生的氢气的物质的量是相等的。则本题就归结到探讨产生等量氢气时铁与硅物质的量之比上来,由关系式:2Fe~Si~2H2,可快速得解。
