某学习小组同学用如图装置探究碳还原氧化铜的过程.
(1)刚开始预热,试管②中立即产生气泡,但石灰水不变浑浊,原因是______;
(2)继续加热,观察到的现象有:石灰水逐渐变浑浊、______.
(3)小欣从课外书上看到,碳还原氧化铜可能生成红色的氧化亚铜 (Cu2O)固体,上述实验中产生的红色固体是否含有氧化亚铜?于是他们继续探究.
【查阅资料】氧化亚铜难溶于水,Cu2O+H2SO4(稀)=Cu+CuSO4+H2O
【实验探究】
| 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| 取少量的红色固体,置于烧杯中,向其中加入足量______,充分搅拌,静置. | ______ | 猜想成立 |
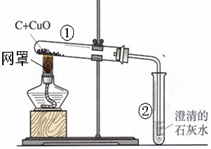
(1)刚开始预热,试管①中的空气受热膨胀使试管②中立即产生气泡,由于气泡主要是空气,因此石灰水不变浑浊;故答案为:刚开始产生的气泡为试管中原有的空气;
(2)由右图可以看出发生的反应是木炭(黑色)和氧化铜(黑色)在高温条件下,生成红色的铜和二氧化碳气体(使石灰水逐渐变浑浊);故答案为:黑色粉末变红;
(3)由【查阅资料】可知:氧化亚铜难溶于水,Cu2O+H2SO4(稀)=Cu+CuSO4+H2O,由于生成的硫酸铜溶液是蓝色的,铜不和稀硫酸反应;因此要想证明红色固体中含有氧化亚铜,可以加入足量的稀硫酸,如果看到溶液变成蓝色,则有,否则则没有.故答案为:稀硫酸 无色溶液变成蓝色;
可设红色固体7.2g都是氧化亚铜,则反应后生成铜的质量为X
Cu2O+H2SO4(稀)=Cu+CuSO4+H2O
144 64
7.2gX
=144 64 7.2g x
解之得:X=3.2g
当红色固体全部是氧化亚铜时产生的固体A的质量最小,当红色固体全部是铜时固体A的质量最大.由于红色固体中还有铜,因此A的取值范围为:3.2g<Ag<7.2g;故答案为:3.2<A<7.2.
