Cl2合成有机物时会产生副产物HC1。4HCl+O2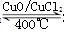 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
完成下列填空:
(1)该反应平衡常数的表达式K= ;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L∙ min。
(2)若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是 。
a.v (HCl)="2" v(Cl2)
b.4v正(HCl)= v逆(O2)
c.又加入1mol O2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
(3)下图是该反应两种投料比[n (HCl):n (O2)分别为4:1和2:1 ] 下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是 。
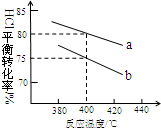
a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(4)投料比为4:1、温度为400℃时,平衡混合物中Cl2的物质的量分数是 。
(1)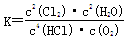 (1分) 0.0625mol/L∙min (1分)
(1分) 0.0625mol/L∙min (1分)
(2)a c(2分)
(3)a d(2分)
(4)0.3529(0.353、0.35均可)(2分)
题目分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式4HCl+O2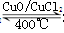 2Cl2+2H2O可知,该反应的平衡常数
2Cl2+2H2O可知,该反应的平衡常数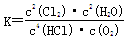 ;8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则:
;8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则:
4HCl+O2 2Cl2+2H2O 物质的量减少△n
2Cl2+2H2O 物质的量减少△n
4mol 1mol
n(HCl) 2.5mol-2.25mol=0.25mol
所以n(HCl)=0.25mol×4=1mol
则c(HCl)=1mol÷2L=0.5mol/L
故v(HCl)=0.5mol/L÷8min=0.0625mol/(L•min)
(2)a.平衡时不同物质表示的速率之比等于化学计量数之比,故v(HCl)=2v(Cl2),因此a正确;b.4v正(HCl)=v逆(O2),即4v正(HCl): v逆(O2)=1:4,不等于化学计量数之比4:1,反应未到达平衡,向逆反应进行,故b错误;c.加入1mol O2,氧气的浓度增大,平衡向正反应方向移动,HCl的转化率增大,故c正确; d.分离出H2O,生成的浓度降低,达新平衡时,v正(HCl)降低,故d错误,答案选ac。
(3)a.由图可知,投料比一定时,温度越高HCl的转化率越低,故该反应正反应是放热反应,因此a正确;b.升高温度平衡向逆反应方向移动,平衡常数k降低,故b错误;c.平衡常数增大应降低温度,平衡向正反应方向移动,改变体积瞬间反应速率降低,此后正反应速率降低、逆反应速率增大,故c错误;d.平衡常数增大应降低温度,该反应正反应是放热反应,平衡向正反应方向移动,故d正确,答案选ad。
(4)增大一种反应物的浓度,平衡向正反应方向移动,其它反应物的转化率增大,故投料比n(HCl):n(O2)=2:1到达平衡时HCl的转化率更高。由图象可知,a曲线表示的HCl的转化率更高,故a表示投料比为2:1,b表示投料比为4:1。由图可知,投料比为4:1、温度为40℃时,HCl的转化率为75%,设n(HCl):=4mol、n(O2)=1mol,则参加反应的HCl为4mol×75%=3mol,则:
4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
起始量(mol) 4 1 0 0
变化量(mol) 3 0.75 1.5 1.5
平衡量(mol) 1 0.25 1.5 1.5
所以平衡混合物中Cl2的物质的量分数是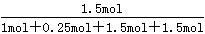 =0.3529。
=0.3529。
