(10分)从某铝镁合 金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是 。
后来的反应速率相当快的原因是 。
(3)写出所形成的原电池的负极材料名称:
电 极反应式:
极反应式:
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据。(请逐一写出)
(1)产生的主要现象有:切口断面处先产生气泡,反应先是较慢逐渐加快;小块合金片在溶液中上下翻动;溶液温度升高(试管外触摸发烫);反应后的溶液中残留了黑色固体。
(2)开始时产生气泡的速度较慢是因为合金表面 有氧化膜。后来反应相当快的原因有:氢氧化钠溶液的浓度较大、铝镁合金片在反应时形成了许多微型原电池、反应放热溶液的温度升高等等。
有氧化膜。后来反应相当快的原因有:氢氧化钠溶液的浓度较大、铝镁合金片在反应时形成了许多微型原电池、反应放热溶液的温度升高等等。
(3)正极(镁):6H2O+6e=3H2+6OH-。负极(铝):2Al+4OH—6e=2AlO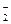 +2H2O。
+2H2O。
(4)至少有四种途径:测定残留固体(镁)的含量;测定产生氢气的体积;测定生成的偏铝酸钠的量;测定反应中有多少氢氧化钠被消耗掉

