向mg镁和铝的混合物中加人适量的稀硫酸.恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加人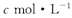 的氢氧化钠溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将所得沉淀灼烧至质量不再改变为止,得到固体p g0则下列关系不正确的是
的氢氧化钠溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将所得沉淀灼烧至质量不再改变为止,得到固体p g0则下列关系不正确的是
A.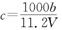
B.
C.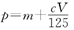
D.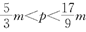
答案:B
答案:B
此题综合性较强,考查的主要是转化中的元素守恒和电荷守恒关系,又是字母,所以,先要将条理理清
Mg和Al共mg
--加入硫酸,恰好完全反应,生成H2为b L
Mg + H2SO4 = MgSO4 + H2
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
--加入c mol·L-1的KOH为V mL,刚好沉淀,Mg(OH)2和Al(OH)3为n g。
Mg2+ + 2OH- = Mg(OH)2
Al3+ + 3OH- = Al(OH)3
--将沉淀灼烧,得到固体MgO和Al2O3为p g
可以得到这样几个关系
(1)KOH中的OH-完全进入沉淀,所以,
沉淀Mg(OH)2和Al(OH)3质量=Mg和Al的质量+OH-的质量
即,n =" m" + 17cV/1000
即,B错误,没有注意到V的单位是mL
(2)由第一步反应知道,生成H2为bL,即b/22.4mol,即H元素化合价降低2b/22.4=b/11.2
则,金属化合价升高共b/11.2,即OH-的量,得到
cV/1000=b/11.2
即,c=1000b/11.2V
即,A正确
(3)最后的氧化物质量=金属质量+O元素质量
O元素是-2价,所以物质的量=(b/11.2)/2=b/22.4
即,p=m+16b/22.4
代入b与c的关系,即A的式子,就得到,p=m+cV/125
即,C正确
D、正确,假设mg全部是镁,那么得到氧化镁P=40m/24=(5/3)m
如果mg全部是铝,那么得到氧化铝P=102m/54=(17/9)m
如果mg是镁铝混合,那么有(5/3)m<p<(17/9)m
则,D肯定正确
所以,错误的是B
