(14分)密闭容器中发生如下反应:2X(g)+Y(g)  Z(g);△H <0
Z(g);△H <0
下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但各物质的用量都没有改变。
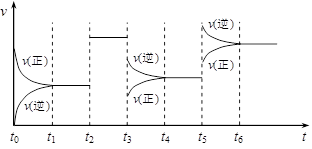
(1)t2 时外界条件的改变可能是 (填序号,下同);t5时外界条件的改变可能是
a.加入催化剂 b.减小压强 c.增大压强 d.升高温度
(2)t3 时,反应物X的转化率 (填“大于”、 “小于”或“等于”)t4时的反应物X的转化率。
(3)在 t 6时,固定容器体积,再向上述容器中充入1 mol氦气,此时,平衡 (填“是”或“否”)会发生移动。
(4)T℃时,若将2 mol X和1 mol Y在1 L的容器中混合,在 t1(t1=2s)时达到平衡,测得Z的浓度为0.5 mol·L-1,则2s 内用物质X表示的平均反应速率为 ;t1时反应物Y的转化率为 ;T℃时,该反应的平衡常数为 。
(14分)(1)a b (2)大
(3)否 (4)0.5 mol·L-1·s-1 ; 50% ; 1
题目分析:(1)t2 时正逆反应速率同时增大,但平衡不移动。应用反应是体积减小的可逆反应,所以外界条件的改变可能是使用了催化剂,答案选a;t5时正逆反应速率都是减小的,但平衡向逆反应方向移动。由于正反应是放热反应,所以改变的外界条件的可能是减小了压强,答案选b。
(2)t3到t4是反应向逆反应方向移动,所以t3 时,反应物X的转化率大于t4时的反应物X的转化率。
(3)固定容器体积,再向上述容器中充入1 mol氦气,但容器中物质的浓度不变,所以平衡不移动。
(4)根据反应的方程式可知,此时X的浓度减少了1mol/L,所以X的反应速率是1mol/L÷2s=0.5 mol·L-1·s-1。消耗Y的物质的量是0.5mol,所以Y的转化率是0.5÷1=50%。该反应的平衡常数为 。
。
点评:外界条件对平衡状态的影响,一般遵循勒夏特例原理。但需要注意的是压强对平衡状态的影响是通过改变浓度引起的,所以不能直接根据压强变化来判断。
