在2L密闭容器中充入1mol H2和1mol I2蒸气,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)==2HI(g) △H<0达到平衡时候n(H2)为0.8mol
(1) 保持容器容积不变,向其中加入1molH2,反应速率 (填加快、减慢、不变、不确定),理由是 。
(2) 保持容器气体压强不变,向其中加入1molHe,反应速率 (填加快、减慢、不变、不确定),理由是 。平衡 (正向或逆向或不)移动
(3)计算该温度下的平衡常数
(1)加快 增加反应物氢气的浓度,反应速率加快,
(2)减慢 体积增大,浓度降低,所以反应速率减慢 不
(3)K=0.25
题目分析:(1)增大反应物氢气的浓度,反应速率增大。
(2)保持容器气体压强不变,向其中加入1molHe,则容器容积必然是增大的,所以物质的浓度是降低的,因此反应速率降低;由于正反应是体积不变的可逆反应,所以改变压强平衡不移动。
(3)达到平衡时候n(H2)为0.8mol,则消耗氢气是0.2mol,因此消耗单质碘也是0.2mol,生成HI是0.4mol,所以平衡时氢气、单质碘和HI的浓度分别是(mol/L)0.4、0.4、0.2,因此平衡常数K=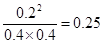 。
。
点评:压强对反应速率或平衡状态的影响只能适用于有气体参加或生成的,且实质是通过改变浓度引起的。而化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值。
