(10分) 将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
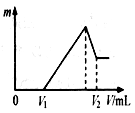
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如右图所示。当V1=140mL时,则金属粉末中n(Mg)= mol,V2= mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入480 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:
(4)若滴加NaOH溶液致V2ml时,停止滴加NaOH溶液,开始往溶液中通入足量CO2,请写出发生反应的离子方程式——————————————————————-————。
(1)0.04mol;460ml
(2)400ml
(3)1> a≧0.2
(4)CO2+2H2O+AlO2-=Al(OH)3 +HCO3-
(1)根据图像可知硫酸是过量的,当V1=140mL时,和金属反应的硫酸是0.2mol-0.14mol÷2=0.13mol。
设混合物中镁和铝的物质的量分别是x、y,则x+y=0.1mol、x+1.5y=0.13mol,解得y=0.06mol,x=0.04mol。
所以和氯化镁、氯化铝反应消耗的氢氧化钠分别是0.08mol和0.18mol,而溶解氢氧化铝消耗的氢氧化钠是0.06mol,共计0.32mol,需要氢氧化钠溶液的体积是320ml,所以V2=140ml+320ml=460ml
(2)根据(1)可知,要生成的沉淀最多,需要氢氧化钠溶液的体积是400ml
(3)当沉淀的量最大时,溶液为中性的硫酸钠溶液,若使沉淀中的Al(OH)3↓全部溶解,则其量0.1—0.1a≤0.48—0.1×2×2=0.08,解得a≥0.2,而对于金属混合物来说,a一定<1,故1> a≧0.2
(4)若滴加NaOH溶液致V2ml时,溶液为NaAlO2溶液,往溶液中通入足量CO2:CO2+2H2O+AlO2-=Al(OH)3 +HCO3-
