甲、乙两个等体积的集气瓶中充满压强为101.3千帕的空气,瓶内各置一个燃烧匙,分别盛有过量的红磷和硫粉,每个集气瓶的橡皮塞上都插有一根带活塞的通入水(含紫色石蕊)中的玻璃管(见图).先关闭活塞,使两个集气瓶处于密闭状态.点燃燃烧匙中的红磷和硫粉(注:点燃装置未在图中画出).待燃烧结束后,冷却至室温.再同时打开两边的活塞,可看到什么现象?并解释之.
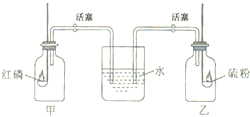
现象及①因过量的红磷燃烧时将甲瓶内的氧气耗尽,而生成物(P2O5)常温下为固体,因此燃烧后甲瓶内呈负压状态,打开活塞后导致倒吸;因氧气约占空气的五分之一,故吸入水的体积约占甲瓶体积的五分之一,又因P2O5遇水生成酸,故石蕊变成红色;
②刚打开乙瓶活塞时未见任何变化,但等待一段时间后,发现玻管中水位逐渐升高,水慢慢地进入乙瓶并变成红色.当变化停止时,进入乙瓶的水的体积同样约是瓶体积的五分之一,虽然过量硫的燃烧同样耗尽了乙瓶中的氧气,但该反应是一个气体分子数不变的反应:S+O2
SO2,生成的二氧化硫是气体.根据阿伏加德罗定律,反应前后瓶内压强不变,因此活塞刚开启时液面不发生变化,但随着SO2分子的扩散,当SO2分子与水接触时被水溶解,这时乙瓶内开始出现负压,因此水缓慢地进入乙瓶,当SO2被全部溶解时,进入乙瓶的水的体积约占瓶体积的五分之一,又SO2遇水同样生成酸,石蕊也呈现红色. 点燃 .
