(12分)
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:

回答下列问题:
(1)上述方案中,能测出Mg的质量分数的方案是 (填写代号,下同)
A.实验设计1 B.实验设计2 C.实验设计3 D.都可以
(2)上述方案中的化学反应体现了Mg、Al的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)某同学设计了右图装置。该装置适合的实验设计是
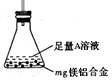

用该装置测定镁铝合金中镁的质量分数,所需的实验操作是
。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.称量反应前后,装置和药品的总质量
(4)若按实验设计3进行实验。将m g镁铝合金,溶于过量盐酸中,再加入过量的NaOH溶液,可得到白色沉淀,该沉淀物质是 (填化学式);将此沉淀洗净、干燥后,称得质量为w g。求合金中镁的质量分数 ;
(1)D(2分) (2)B (2分) (3) B (2分) B (2分)
(4)Mg(OH)2 (2分) 12w/29m(2分)
(1)设计(1)根据镁铝合金质量及氢气的体积可计算出结果,设计(2)铝能溶于强碱而镁不溶可知剩余的是镁,设计(3)利用Al(OH)3能溶于强碱而Mg(OH)2不溶于强碱可求解;(2)金属和酸反应或和碱反应都表现了还原性;(3)设计1需要气体收集装置,设计3第一步反应完还需要继续加NaOH溶液,所以,此装置只适用于设计2,因镁不溶于NaOH溶液,所以剩余固体即为镁;(4)因Mg(OH)2不溶于NaOH溶液Al (OH)3能溶于NaOH溶液,可知剩余的是Mg(OH)2,根据镁的物质的量等于氢氧化镁的物质的量,质量等于物质的量乘以摩尔质量这一计算式可求出镁的质量,再用镁的质量除以m克乘以100%,即可求出镁的质量分数。
