(14分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
⑴ 在一定体积的密闭容器中,进行化学反应: CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:

①该反应正向反应是 反应。(填“放热”或“吸热”)
②能判断该反应达到化学平衡状态的依据是 。

A.容器压强不变
B.混合气体中c(CO2)不变

C.υ正(H2)=υ逆(H2O)
D.c(CO2)=c(CO)③当其他条件不变时,若缩小容器的体积,该反应平衡 移动。(选填“正向”、“逆向”或“不”)
⑵工业上合成甲醇可在密闭容器中采用如下反应进行:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
①该反应的平衡常数表达式K= 。
②某实验将1molCO2和3molH2充入一定体积的密闭容器中,在两种不同条件下发生反应(只有一种条件不同)。测得CH3OH的物质的量随时间变化如图所示:
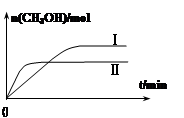
曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(选填“>”、“=”或“<”)。
③一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(14分)
⑴吸热 BC 不
⑵ > 0.15 0.5<c≤1 (每空2分)
> 0.15 0.5<c≤1 (每空2分)
题目分析:化学反应: CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
由以上表格看到:随着温度升高,k值增大;即平衡向正向移动,即正向是吸热方向;
①该反应正向反应是吸热反应。
反应前后化学计量数不变,所以整个过程压强始终不变,所以能判断该反应达到化学平衡状态的依据是 :混合气体中c(CO2)不变
:混合气体中c(CO2)不变 ;υ正(H2)=υ逆(H2O) ;当其他条件不变时,若缩小容器的体积,该反应平衡不移动。
;υ正(H2)=υ逆(H2O) ;当其他条件不变时,若缩小容器的体积,该反应平衡不移动。
⑵工业上合成甲醇可在密闭容器中采用如下反应进行:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
①该反应的平衡常数表达式K= 。
。
②某实验将1molCO2和3molH2充入一定体积的密闭容器中,在两种不同条件下发生反应(只有一种条件不同),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ。
③一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
甲: 1mol 3mol 0 0
乙: a mol b mol c mol c mol
要使平衡后乙容器与甲容器中相同组分的体积分数相等,起始时维持化学反应向逆反应方向进行,所以c的最大值是1,平衡时CO2的转化率为50%,,所以最小值是0.5则c的取值范围为0.5<c≤1
点评:等效平衡 化学反应速率
点评:对于化学平衡的计算学生必须要掌握的知识有:三行式; 化学反应速率的计算公式:v=Δc/Δt ;等效平衡的三种情况:
I类:恒温恒容下对于反应前后气体体积发生变化的反应来说(即△V≠0的体系):等价转化后,对应各物质起始投料的物质的量与原平衡起始态相同。
II类:恒温恒容下对于反应前后气体体积没有变化的反应来说(即△V=0的体系):等价转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。
III类:恒温恒压下对于气体体系等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。
