(15分) “材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请回答下列问题:
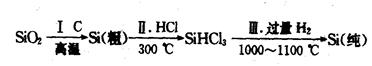
(1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
①写出步骤I的化学方程式:_______________________________________。
②步骤II经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的实验方法是__________________________。
(2)磁性材料。这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的使用开始就不断实施着对它的防护。最常见的铁制品腐蚀就是电化学腐蚀,请写出最为普遍的电化学腐蚀的负极反应式:_______________________。
(3)激光材料。我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:______ _ 、______________。
(4)高分子材料。它可以分成无机高分子材料和有机高分子材料。一种新型高效净水剂[Al Fe (OH)n Cl6-n]m就属于无机高分子材料,它广泛应用生活用水和工业污水的处理,其中铁元素的化合价为________;一种合成纤维腈纶,又称“人造羊毛”,由丙烯腈(CH2=CH-CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式: _____________________。
(5)合金材料。14g铜银合金与一定量某浓度的硝酸完全反应后,将放出的气体与1.12L(标准状况下)O2混合通入水中,恰好全部被水吸收,则合金中铜的质量为_______g。
理科综合试卷·第1页(共16页) |
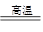 Si+2CO↑ ②蒸馏(或分馏)(2)Fe-2e-=Fe2+(3)Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=2AlO2-+H2O
Si+2CO↑ ②蒸馏(或分馏)(2)Fe-2e-=Fe2+(3)Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=2AlO2-+H2O(4)+3 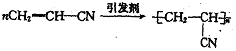
(5)3.2g
(1)①高温下,碳能还原二氧化硅生成硅,方程式为SiO2+2C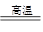 Si+2CO↑。
Si+2CO↑。
②由于SiHCl3(沸点为33.0℃)和SiCl4(沸点为57.6℃)沸点相差比较大,所以可以通过蒸馏进行提纯。
(2)钢铁主要发生电化学腐蚀,铁作负极,失去电子,方程式为Fe-2e-=Fe2+。
(3)两性氧化物既能溶于酸生成盐和水,又能溶于碱生成盐和水,所以方程式为Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=2AlO2-+H2O。
(4)根据化学式可知,负价总计是-6,而铝是+3价的,所以铁是+3价的。丙烯腈中含有碳碳双键,能发生加聚反应,生成高分子化合物,方程式为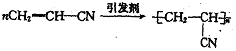 。
。
(5)反应中产生的气体是氮氧化物,和氧气反应生成的是硝酸,所以合金所失去的电子相当于被氧气得到,即转移电子是1.12L÷22.4L/mol×4=0.2mol。合金中铜、银的物质的量分别是x、y,则2x+y=0.2、64x+108y=14,解得x=0.05mol,y=0.1mol,所以铜的质量是3.2g。
