精密量取维生素C注射液4ml(2ml:0.1g),加水15ml与丙酮2ml,摇匀,放置5分钟,加稀醋酸4ml与淀粉指示液1ml,用碘滴定液(0.05mol/L)滴定,至溶液显蓝色并持续30秒钟不褪。每1ml碘滴定液(0.05mol/L)相当于8.806mg的维生素C(CHO)。消耗的碘滴定液(0.05mol/L)的体积和浓度分别是10.90ml和0.0506mol/L。根据上述实验,判断正确的是()
A.本实验利用了维生素C具有很强的氧化性
B.本实验维生素C注射液的含量95.98%
C.本实验维生素C注射液的含量97.13%
D.滴定终点溶液显紫色
E.本实验维生素C注射液的含量97.14%
参考答案:E
解析:
利用维生素C具有很强的还原性,在稀醋酸的酸性条件下,以淀粉为指示剂,用0. 05mol/L碘滴定液直接滴定,滴定至溶液显蓝色为终点。根据消耗的碘滴定液(0. 05mol/L)的体积和浓度,计算维生素C注射液的含量。V代表消耗滴定液ml数;C代表滴定液的实际浓度;标示量代表每支注射液中维生素C的克数。本实验维生素C注射液的规格为2ml:0.1g,表示每支容量为2ml,标示量为0. 05g。计算公式如下:维生素C注射液标示量%=

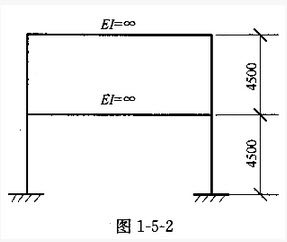
 轴底层柱剪力标准值V(kN),应与下列何项数值最为接近()?
轴底层柱剪力标准值V(kN),应与下列何项数值最为接近()?