MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下:
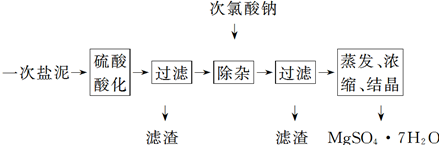
(1)用硫酸调整溶液pH为1~2,硫酸的作用是________________________________________。
(2)加次氯酸钠溶液至pH为5~6并加热煮沸约5~10 min,滤渣中主要含MnO2和另两种沉淀:__________________、____________(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为________________________ ___
(3)若除杂后过滤,发现滤液发黄,需采取的措施是____ ____
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是________________________________________
(5)晶体中结晶水含量的测定:准确称取0.20 g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚中,置于马沸炉中,在200 ℃脱水1 h。为准确确定脱水后的质量,还需要经过的操作有冷却(干燥器中)至室温→__________ _________________
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50 g,用200 mL水溶解,加入2 mol·L-1 HCl溶液5 mL,将溶液加热至沸腾,在不断搅拌下逐滴加入5~6 mL 0.5 mol/L BaCl2溶液,充分沉淀后,得沉淀0.466 g,则样品中w(SO42-)=________________。
(7)已知:Na2CO3·10H2O (s)=Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式__ __________。
(1)浸出Mg、Fe、Al、Mn离子,除去Si、Ca;
(2)Al(OH)3、Fe(OH)3;Mn2++2OH一+C1O一=MnO2↓+Cl一+H2O;
(3)添加适量的次氯酸钠溶液,再煮沸、过滤;
(4)减小硫酸镁的溶解损耗,并快速干燥;
(5)称量后重复脱水→冷却→称量至恒重;
(6)38.4%;
(7)Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH=+58.73KJ/mol
(评分标准:除(2)前2空各1分,其余每空2分,方程式若有漏写“↑”“↓”或者反应条件未写,均扣1分;若配平有误,扣2分,共16分)
题目分析:(1)将盐泥中的碳酸盐、硅酸盐转化为硫酸盐,硅酸盐转化为硅酸(SiOrnH2O)沉淀,钙盐转化为硫酸钙沉淀而除去,
(2)Al3+、Fe3+水解生成Al(OH)3、Fe(OH)3,NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-;
(3)滤液发黄可能含有三价铁离子,可添加适量的次氯酸钠溶液,次氯酸钠显碱性,可促进三价铁离子的水解,再煮沸、过滤
(4)用丙酮代替蒸馏水洗涤可减小硫酸镁的溶解损耗,并快速干燥,
(5)重复脱水后至恒重说明已经完全脱水
(6)m(SO42-)=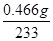 ××96=0.192g,w(SO42-)=
××96=0.192g,w(SO42-)= =38.4%,
=38.4%,
